Ásvány- és kőzettan
A Föld története
Az Univerzum keletkezése
„Adjatok anyagot, világot építek belőle!" Immanuel Kant
Az Univerzum kezdeti állapotáról biztosat nem tudunk, elméletekben azonban nincs hiány. A ma leginkább elfogadott modell, amelyet George Gamov elméleti fizikus dolgozott ki Kant nyomán az ún. „Big-bang", a nagy robbanás elmélete. Eszerint a jelenlegi Univerzum egy ősanyag gigantikus robbanása következtében jött létre kb. 10-20 milliárd évvel ezelőtt. Az ősanyag sűrűsége szerinte 1025 g/cm3, hőmérséklete pedig 1016 K lehetett, ezen rendkívül sűrű és forró „tűzgömb" robbanásszerű kiterjedésével magyarázható az Univerzum ma észlelt expanziója.
Az Univerzum tágulásáról bővebben: http://cas.sdss.org/dr4/hu/proj/basic/universe/
 „Big-bang", avagy a „Nagy Bumm"
„Big-bang", avagy a „Nagy Bumm"
Forrás: http://www.space-art.co.uk/pages-en/formations/Big-Bang.htm
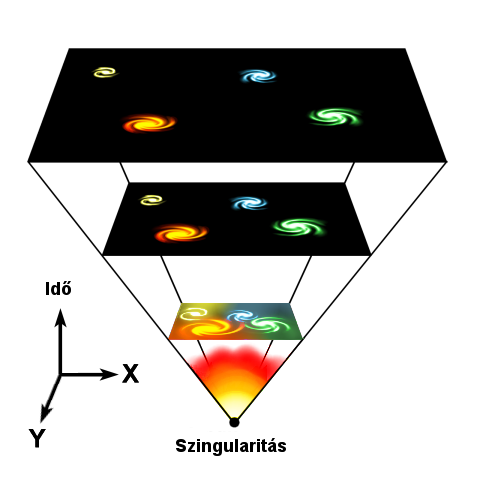 A Világegyetem tágulása
A Világegyetem tágulása
Forrás: http://hu.wikipedia.org/
|
Idő |
Hőmérséklet |
Fontosabb jelenségek |
|
0 |
¥ |
Részecske nélküli massza. |
|
10-16 s |
1013 K |
Hadronkorszak: Gyakorlatilag minden részecske jelen van. Nukleonok és antinukleonok szétválása, majd annihilációja. |
|
10-4 s |
1012 K |
Leptonkorszak: (elektronok, müonok, neutrínók stb.). A hőmérsékleti sugárzás jellemzőit a részecskék erős kölcsönhatásai határozzák meg. Az annihilációs időszak vége. |
|
1 s |
1010 K |
Foton korszak: A korszak elején a nukleonok kevés szerepet játszanak, a világ csaknem csupa fotonból áll. |
|
106 év |
3*103 K |
Nukleonkorszak: A sugárzás lehűl. A nukleonok energiasűrűsége nagyobb lesz mint a fotonoké. Az elemi egységek atomokká állnak össze (H, He). |
|
máig |
3 K |
Sűrűsödések korszaka: A helyi sűrűség növekedések gázfelhőkké sűrűsödhetnek és őscsillagokká vagy csillaghalmazokká alakulhatnak át, amelyekben magasabb rendszámú elemek képződhetnek. Felrobbanó csillagok gondoskodnak az újonnan képződő elemek szétszóródásáról, további csillagnemzedékek formálódnak. A csillagok környékén lévő porfelhők bolygókká sűrűsödnek. Alkalmas hőmérsékletű és tömegű bolygók felületén szerves anyagok keletkezhetnek. |
Az Univerzum fejlődéstörténete
A Naprendszer és a Föld születése
A napjainkban leginkább elfogadott tudományos elmélet szerint, a Naprendszer 4,57 milliárd évvel ezelőtt, egy szupernóva robbanás közvetlen szomszédságában, a csillagközi anyagok (atomok, molekulák) gravitációs erő által előidézett kondenzációja révén jött létre. Az összehúzódó rendszer középpontja csillaggá alakult, míg a külső részekből viszonylag nagy sűrűségű, forgó korong képződött. Eközben a gravitáció potenciális energiája hőenergiává alakult át, és a hőmérséklet növekedni kezdett. Ehhez a hőmérséklet-növekedéshez a radioaktív nuklidok spontán, exoterm hasadása is hozzájárult (40K19, 235U92 stb.). Mivel a rendszerben a Nap tömege a legnagyobb, hőmérséklete elérte a 2*107 K-t, és ez elegendő volt a magfúziós reakció beindulásához. A Nap tehát csillag lett, míg a többi égitest (protobolygók) a Naphoz viszonyítva lényegesen kisebb tömege miatt nem érhette el a magfúzióhoz szükséges hőmérsékletet.
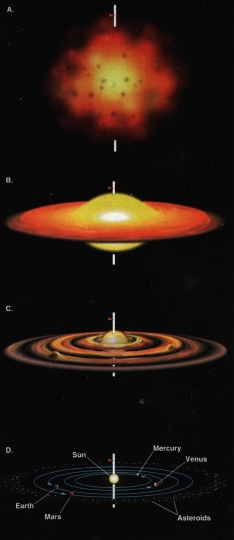 A Naprendszer keletkezése
A Naprendszer keletkezése
Forrás: http://foldrajz.ttk.pte.hu/foldtan/kornyezettan/fold1.ftt.uni-miskolc.hu/f1.htm
A Nappá sűrűsödő gázfelhőn kívül maradt a perdület leadása során lecsatolódott szoláris köd, mely a bolygórendszer alapanyaga volt. A szoláris köd hőmérséklete az ős-Naptól távolodva csökkent. A köd hőmérséklet-eloszlása határozta meg, hogy az ős-Naptól adott távolságban mi kristályosodott ki. Az ős-Naptól távolodva vas-nikkel, piroxén, földpát, olivin, troilit - a fő meteoritalkotó ásványok -, tremolit, szerpentin, vízjég, ammónia-hidrát, metán-hidrát voltak a legfontosabb kiváló anyagok. A kivált kristályszemcsékből álló „kristálygáz" (porfelhő) lecsatolódott a maradék szoláris ködről, másként hűlt, mint a gáztér. Rugalmatlan ütközésekkel csomósodott. Ez alakította ki bolygórendszerünknek ma is megfigyelhető tömegarányát.
Ha a bolygók keletkezésének imént bemutatott elmélete igaz, akkor a Föld, a Naprendszer többi bolygólya, a meteoritok és aszteroidok eredete közös. Ez az elmélet - hipotetikus jellege ellenére is - támpontot ad ahhoz, hogy az elemek relatív gyakoriságát és eloszlását mai Földünkön értelmezni tudjuk, mivel feltételezhető, hogy valamennyi égitest elemi összetétele eredetileg az intersztelláris köd, illetve a Nap összetételével azonos volt. A Föld életkora mintegy 4,5 milliárd év. A gázállapotú és szilárd anyagrészecskék kezdődő kondenzációjának és aggregációjának idején a hőmérséklet néhány száz K lehetett. Ily módon néhány milliárd év alatt a Föld anyagának felmelegedése és részben megolvadása, az alkotók sűrűség szerinti elválása, a kondenzált fázis gázvesztesége, továbbá a földkéreg lassú lehűlése és kristályosodása során alakult ki bolygónk mai szerkezete. A Naprendszerünk szerkezetét pedig a bolygók és a kisebb égitestek mozgásai, és ezek anyagi összetétele határozza meg.
„A világ fejlődése egy éppen most véget ért tűzijátékhoz hasonlítható: néhány vörös szikra, hamu és füst. Egy kihűlt salakdarabkán állva látjuk a napok lassú kialvását, és megpróbáljuk a világok keletkezésének letűnt ragyogását visszaidézni." Lemaitre
Ajánlott link Bolygók és csillagok, a legkisebbtől a legnagyobbig (az animáció kiválóan szemlélteti az arányokat) Hubble űrtávcső által készített képek (angol nyelvű)
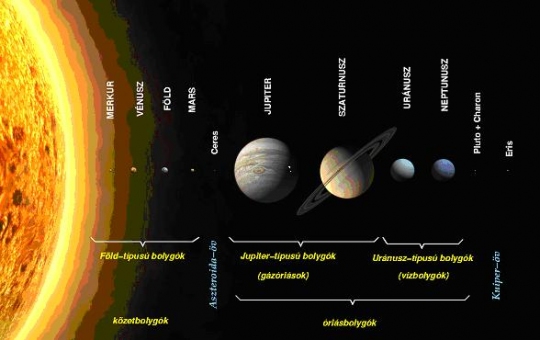
Forrás: http://astro.elte.hu/~kris/csillrajz/Naprendszer.pdf
A Föld szerkezete és kémiai összetétele
Mai ismereteink szerint a Föld fejlődése során a forgás, a fokozatos lehűlés és a gravitáció eredményeképpen gömbhéjakba rendeződtek az anyagok. Ezeket a koncentrikusan elhelyezkedő gömbhéjakat összefoglalva geoszféráknak nevezzük.
A Föld belső gömbhéjai:
- földkéreg
- felső köpeny
- alsó köpeny
- külső mag
- belső mag
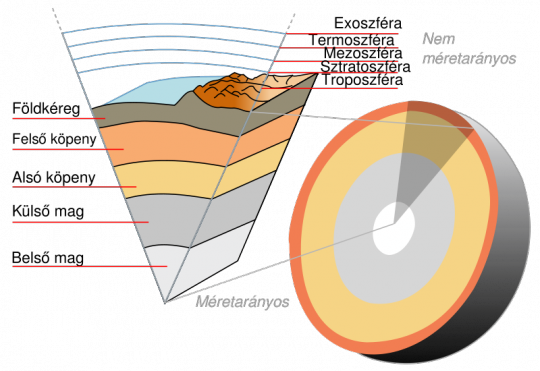 A Föld geoszférái
A Föld geoszférái
Forrás: http://hu.wikipedia.org/
Geoszférák jellemzői:
Földkéreg: a legkülső, szilárd halmazállapotú. Bolygónk tömegének 1 %-a.
|
Szárazföldi kéreg |
Óceáni kéreg |
|
vastagabb (átlag 35 km) |
vékonyabb (5-8 km) |
|
sűrűsége kisebb |
sűrűsége nagyobb |
|
kőzetanyaga gránit |
kőzetanyaga bazalt |
|
idősebb, 3,8 milliárd is lehet |
fiatalabb 200 millió évnél |
|
felépítése változatosabb |
felépítése egyszerűbb |
|
Elem |
%-os arány |
|
oxigén |
46,4 |
|
szilícium |
28,2 |
|
alumínium |
8,2 |
|
vas |
5,6 |
|
kálcium |
4,1 |
|
nátrium |
2,4 |
|
magnézium |
2,4 |
|
kálium |
2,1 |
|
többi elem |
0,7 |
A földkéreg 92 elemből épül fel, de döntő többségét 8 elem alkotja
Földköpeny: felső része szilárd, alatta magas hőmérsékletű, képlékeny állapotú -áramlásai mozgatják a szilárd kőzetlemezeket, asztenoszféra-. A Föld tömegének 68 %-a.
Földmag: fémes (Fe, Ni), jól vezető anyagokból áll, melyek a maghéjban folyékony, a belső magban szilárd halmazállapotban vannak és extrém nyomás alatt állnak. A Föld tömegének 31 %-a.
 A Föld belső szerkezete a magtól a felső köpenyig
A Föld belső szerkezete a magtól a felső köpenyig
Forrás: http://hu.wikipedia.org/
Az ásványok és kőzetek keletkezése
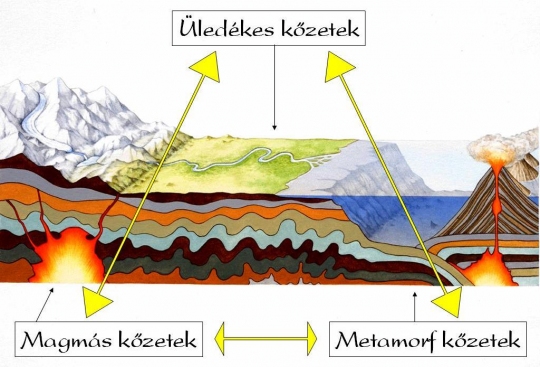
A kőzetek olyan nagy kiterjedésű ásványtömegek, illetve jellemző összetételű ásványegyüttesek, amelyek meghatározott természeti folyamatban egységesen képződnek, s a Föld szilárd kérgét alkotják. Az egy ásvány tömegéből álló kőzeteket monominerális vagy homogén kőzeteknek nevezzük. A kőzetek együttesen képződött ásványok jellemző társulása. A kőzetek keletkezésük szerint három nagy csoportra bonthatóak:
Magmás kőzetek
Magmának nevezzük a természetben megjelenő, sokkomponensű rendszernek tekinthető, jelentős részben szilikát-olvadék összetételű, cseppfolyós fázisból álló, mozgékony kőzetanyagot, amelyben különböző szilárd fázisokat képviselő, már kivált kristályok lehetnek szuszpendálva. Bizonyos körülmények között gázfázis is jelen van. A lehető legegyszerűbben fogalmazva a magma kőzetolvadék (hőmérséklete ~ 1000-1200°C). Az oldott gázoknak szerepe van a magma viszkozitásával, amely hatással van a kristályosodásra. A legfőbb illékony komponensük a következők: H2O, CO2, H2S, S, SO2, HCl, NH4Cl.
A fő komponensek (oxid alakban megadva): SiO2, Al2O3, FeO, Fe2O3, CaO, MgO, Na2O, K2O, TiO2, ez összesen 99,1 t. %-ot tesz ki.
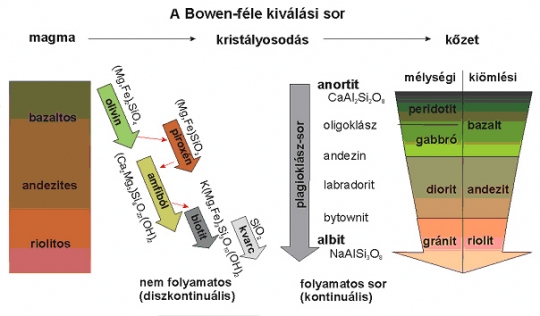
A felszínre kiömlött vagy földkéregben rekedt magma hőmérsékletének csökkenésével megindul az egyes alkotók kiválása. Azaz az olvadékból történő kikristályosodás. Ennek során a kőzetalkotó ásványok olvadáspontjuk fordított sorrendjében válnak ki.
A magmatikus differenciáció, megszilárdulás
A magma igen sok-komponensű olvadék-oldat, éppen ezért a megszilárdulás előtt különböző összetételű részmagmákká válik szét. Három fő szakaszt különböztetünk meg: elő-, fő- és utókristályosodás.
Előkristályosodás
- Likvid magmás elkülönülés: A hőmérséklet csökkenésével csökken a szilikátolvadék és a szulfidolvadék kölcsönös oldhatósága, a két olvadék elkülönül. A magma réz-, nikkel- és platinatartalmának nagy többsége így halmozódik fel.
- Tulajdonképpeni előkristályosodás: 1000°C-on megjelennek az első kristályok. Króm- és titánvasérc, a platinafémek, a gyémánt és a foszfátásványok így képződtek.
Főkristályosodás
Amikor a magma 900°C-ra lehűl, a kőzetek ebben a szakaszban keletkeznek. Az ásványok közül elsőnek az olivin és a piroxének, később a gránit, és a hozzá hasonló kőzetek válnak ki. A magma főkristályosodási szakasza szolgáltatta a Föld szilárd kérgének kb. 94%-át.
Utókristályosodás
A főkristályosodás végén megmaradó olvadék sok kismolekulájú (illékony) anyagot tartalmaz. Feldúsulnak azok az anyagok is, amelyek az eredeti magmában kis koncentrációban voltak jelen. (pl.: Zr, Ce, Be, Mo, W, Sn ásványai).
- Pegmatitos fázis: Megjelennek egyes ritka elemeket (Be, Li, Zr, Nb, Ta, U, Yb) tartalmazó ásványok. A legszebb színes drágaköveket is a pegmatitos fázis szolgáltatja.
- Pheumatolitos fázis: A hőmérséklet 500°C-ra hűl le. A kovasavon kívül csak az illékony anyagok egy része van jelen. A nagy mennyiségben összegyűlő halogénsav-gázok miatt e fázis megtámadhatja a kőzeteket. Cink-, réz-, vasérc, továbbá topáz, fluorit, turmalin, ill. az ón, molibdén, volfrám telepei jórészt ebben a szakaszban jöttek létre.
- Hidrotermális fázis: Amikor a maradék oldat hőmérséklete 378°C-ra lehűl, a víz cseppfolyós halmazállapotúvá válik. Arany-, ólom-, réz-, cink-, higany- és antimonércek itt jönnek létre, ezeket kvarc, kalcit, aragonit, barit, kíséri. Néhol a forró víz mint gejzír tör a felszínre.
- Exhalációs fázis: A maradék anyag tartalmaz gáz halmazállapotú elemeket, ilyenek lehetnek a hélium, kénhidrogén, széndioxid, ammónia, sósav, radon gázok. Más részük vulkáni utóműködés része is lehet. Ily módon nem jelentős kén, szalmiák, esetleg hematit ásványkiválások keletkezhetnek.
A Bowen-féle kiválási sor és az adott ásványos összetételnek megfelelő kőzetek
Forrás: http://foldrajz.ttk.pte.hu/foldtan/segedanyag.pdf
Ajánlott linkek
Üledékes kőzetek
Az üledékes kőzetek kialakulás óceánok, tavak, folyók mélyén lerakódott vagy a mozgó jégtakaró és a szél révén felhalmozott üledékekkel kezdődik. Az üledékek egymásra települnek, az alsóbb rétegek betemetődve egyre mélyebbre kerülnek, eltávozik belőlük a víz és megkeményednek. Évmilliók alatt a diagenezisnek nevezett folyamat során a felső rétegek nyomása és a Föld belsejének hője az üledékrétegeket szilárd kőzetekké alakítja. Az üledékes kőzetek kialakulásánál is meghatározóak a fizikai és a kémiai folyamatok, azonban szemben a magmás és metamorf folyamatokkal itt a Föld külső erői játsszák a döntő szerepet.
 Törmelékes üledék, konglomerátum
Törmelékes üledék, konglomerátum
• Mállás
• Szállítás
• Lerakódás vagy üledékképződés
• Kőzettéválás vagy diagenezis
Mállás
A mállás az ásványtársulásoknak a Föld felszínén végbemenő lebontását, oldását értjük, amely folyamatokban elsőrendű szerepet a víz, illetve a benne oldott anyagok játszanak.
• Fizikai (mechanikai) mállás: a kőzetek felaprózódnak, de kémiai összetételük nem változik meg. Legfőbb tényezői a hőingadozás, fagyhatás, a pórusokban történő sókiválás, hullámverés, növényi gyökerek repesztő hatása, stb.
• Kémiai mállás: a kőzetek komponenseinek oldása vagy kémiai átalakulása. Legfőbb tényezői: a csapadékvíz, a szulfidásványok bomlása során keletkező savak és a bioszféra élőlényeinek és bomló szerves anyagainak savtermelő képessége.
Szállítás
• Gravitáció útján
o Lejtőtörmelékek
o Csuszamlás
o Iszapfolyás
• Szállítóközeg útján
o Jég
o Víz
o Szél
Lerakódás
• Görgetve
• Leülepedés
• Kicsapódás
Üledékgyűjtők
• Erózióbázis szintje feletti (szárazföldi)
• Erózióbázis szintje alatti (tengeri)
Kőzettéválás (diagenezis)
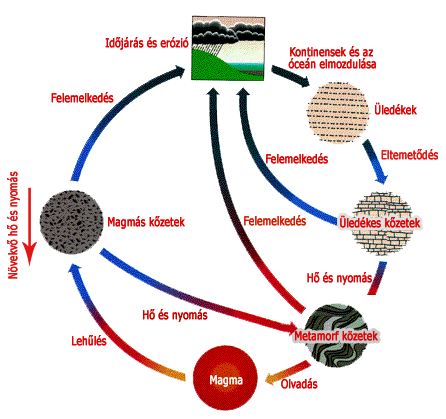
A mállástól a metamorfózisig...
 Törmelékes üledék, kavics
Törmelékes üledék, kavics
Átalakult (metamorf) kőzetek
Metamorfózisnak nevezzük, ha a kőzetek az eredeti kőzetképződési körülményektől eltérően fizikai (hőmérséklet, nyomás) és kémiai körülmények között, szilárd állapotban lejátszódó ásványtani és szerkezeti átalakulási folyamaton mennek át. Ha az eredeti kémiai összetétel változatlan izokémai, ha pedig megváltozik, allokémiai átalakulásról beszélünk.
A metamorfózis osztályozása általában kiterjedés, valamint a két fő fizikai körülmény, a nyomás és a hőmérséklet egymáshoz viszonyított mértéke szerint történik.
A metamorfózis fokozatai:
• Nagyon kisfokú metamorfózis (agyagpala, metabazalt)
• Kisfokú m. (szerpentinit, kloritpala)
• Közepes fokú m. (csillámpala, márvány)
• Nagyfokú m. (eklogit, gneisz)
A kőzetek körforgása
Forrás: http://www.kristalyakademia.hu/
Ajánlott link
Kristálytan - Kristálygeometria
Tartalom
A kristály jellemzői
Tartalom
A kristály jellemzői
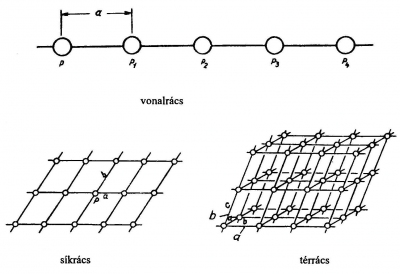
A kristály (ógörög, krüsztallosz = jég) homogén, diszkontinuális térkitöltésű, anizotróp térrács, aminek külső megnyilvánulása a sík lapokkal határolt mértani test.
- Homogén (egynemű), kémiailag teljesen egységes, legkisebb része is az egész kristállyal azonos összetételű.
- Anizotróp. A kristály tehát egy homogén anizotróp test.
- Rendezett.
A kristály tehát atomok, ionok, molekulák szabályos periódikus elrendeződése.
Egy, két és három dimenzióra kiterjedő rendezettség
A kristályok sajátságai
Szimmetrián értjük valamilyen motívum szabályszerű ismétlődését. A kristály külső szimmetriája legegyszerűbben az ún. fedési műveletek segítségével ismerhető fel. Morfológiailag három fedési műveletet különböztetünk meg: forgatás, tükrözés, inverzió. Szimmetria elemnek nevezzük azt a mértani elemet, amellyel a fedési műveletet végrehajtjuk
|
Fedési művelet |
Megfelelő szimmetriaelem |
|
forgatás |
gír v. szimmetriatengely |
|
tükrözés |
tükörsík v. szimmetriasík |
|
inverzió |
inverziós pont v. szimmetriaközpont |
Egyszerű szimmetriaelemek
A gír: Olyan szimmetriaelem, amelynek segítségével a kristály egy teljes körforgás alatt önmagával többször fedőhelyzetbe kerül.
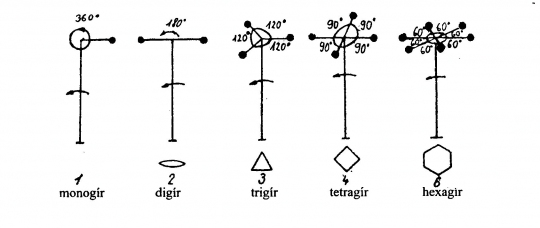
A természetes kristályok lehetséges szimmetriatengelyei (gírjei)
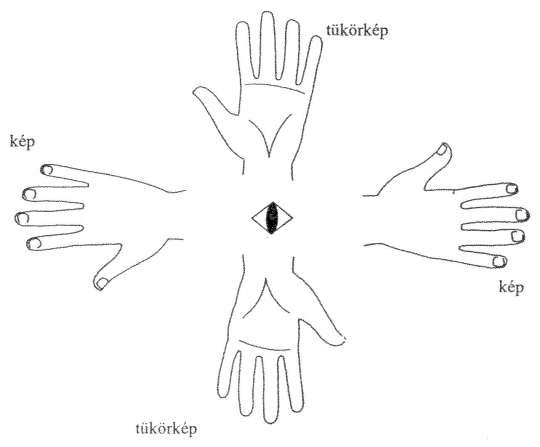
A tükörsík: olyan szimmetriaelem, amely a kristályt két egybevágó tükörképi félre bontja.
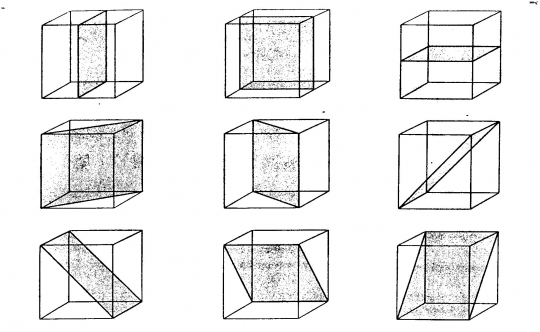
A kocka (hexaéder) 9 szimmetriasíkja
A szimmetria középpont: olyan szimmetriaelem, amelyen áthúzott bármely egyenes azonos kristálytani elemeket köt össze (élt éllel, lapot lappal).
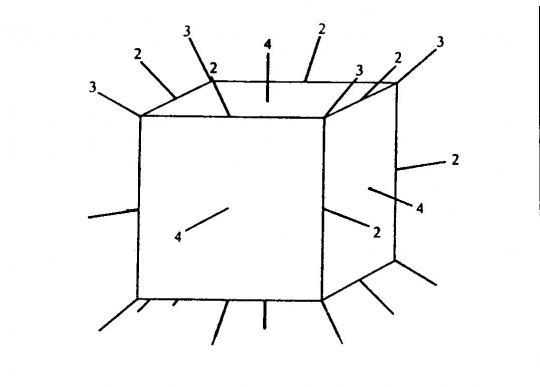
A kocka inverziós pontján átmenő egyenesek.
A számok az egyenessel egybeeső szimmetriatengely értékűségét jelzik
Összetett szimmetriaelemek
Giroid: olyan szimmetriaelem, amely elfordítás közben a kristály eredeti helyzetének a tükörképét is létrehozza.
A tetragiorid egyszerű szemléltetése
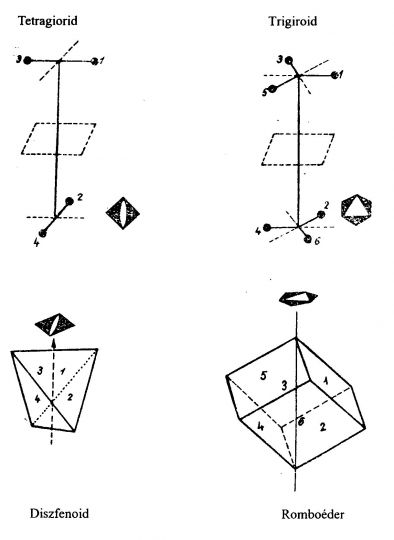
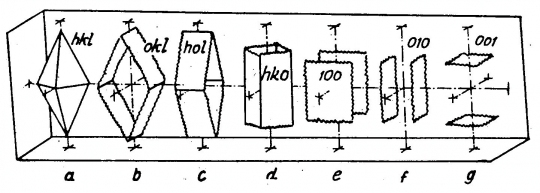
Kristályformák
Az olyan lapok összességét, amely lapok azonos paraméterekkel fejezhetők ki, kristályformának nevezzük. A kristályforma lehet zárt, vagy nyílt. Ha a kristályforma csupa egybevágó lapból áll, egyszerű kristályformáról beszélünk, több egyszerű forma egyidejű fellépése formakombinációt hoz létre. (13/a. ábra). (A segédletben csak a legjellemzőbb formákat tárgyaljuk teljesség igénye nélkül.).
13/a. ábra. a., Egyszerű formák b., Formakombinációk
Nyílt formák:
A nyílt formák lehetnek egy (prizma), vagy két irányban nyíltak (véglap). Nyílt forma a kristályon egymagában nem lehet, csak más formával kombinálódva (13/b. ábra).
13/b. ábra. Véglapok, prizmák és dipiramisok kombinálódását egy kénkristályon
Véglap vagy (pinakoid (pinax = deszka): 2 lapos kristályforma.
Két párhuzamos lapból áll, amelyek általában inverziós pont szerint tartoznak össze.
Prizma hasáb: azok a formák, melynek lapjai egymással párhuzamos élben metsződnek, és digír, trigír, tetragír, vagy hexagír szerint tartoznak össze.
(A főtengelyes rendszerekben a prizma lapjai a c tengellyel párhuzamosak.)
Piramis: azok a formák, amelyek lapjai a c tengelyhez szimmetrikusan hajolnak.
Zárt forma:
Dipiramis: Poláris szimmetriatengelyre merőlegesen a piramisoknál vízszintes tükörsík lép fel, egy alsó és egy felső piramis dipiramist alkot. (14. ábra)
14. ábra. a, dipiramis. b, c, d, prizmák. e, f, g, véglapok
Kristályrendszerek
Az összes lehetséges kristályok 7 féle tengelykeresztbe, (7 féle koordinátarendszerbe), illetve 7 kristályrendszerbe sorolhatók:
1. Szabályos
2. Négyzetes
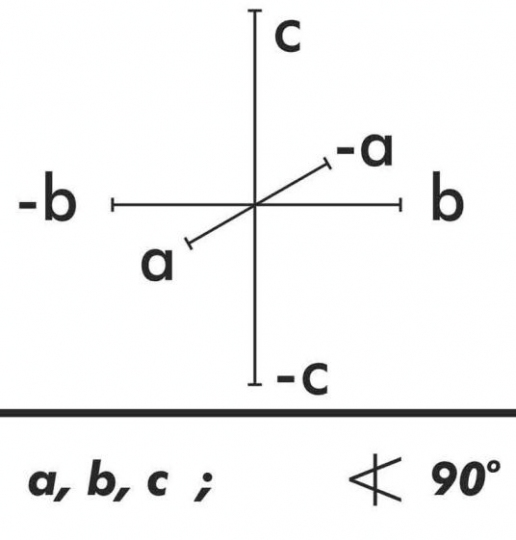
3. Rombos
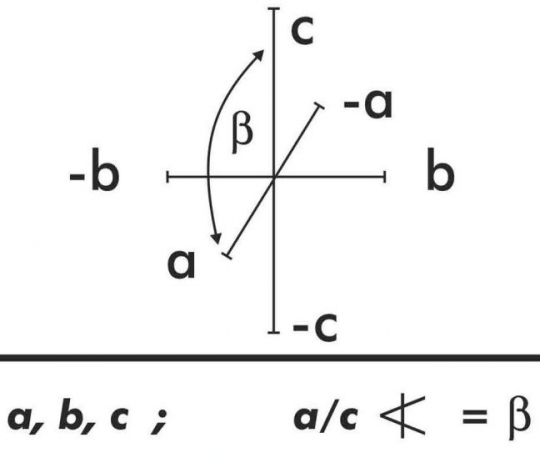
4. Egyhajlású
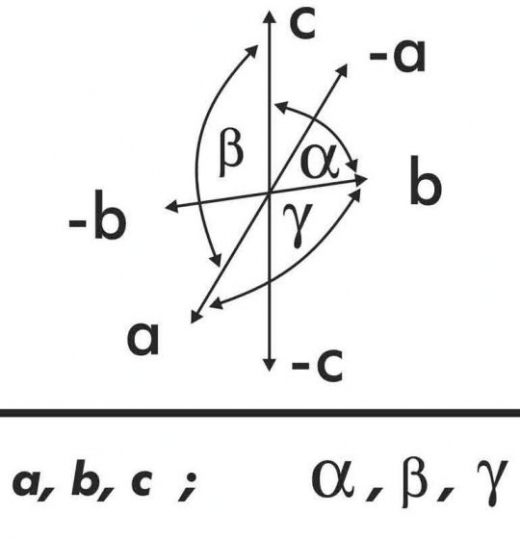
5. Háromhajlású
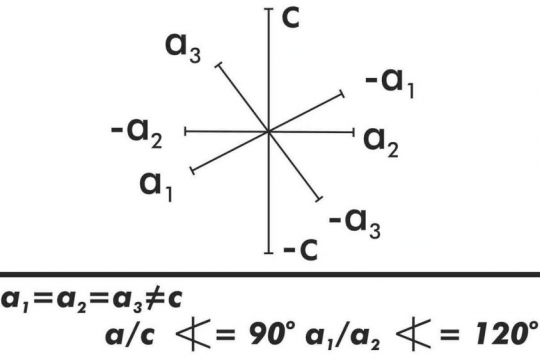
6. Hatszöges
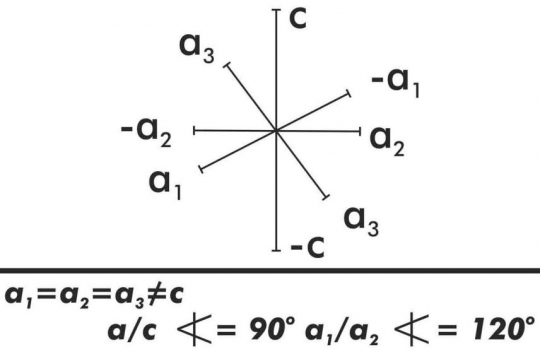
7. Trigonális
Összefoglaló táblázat
Kristálytani tengelyek
A kristálylapok jellemzésére képzeletben térbeli koordinátarendszert létesítünk a kristályban. A koordinátarendszer tengelyei az ún. kristálytani tengelyek a kristály geometriai középpontján mennek keresztül (9. ábra)
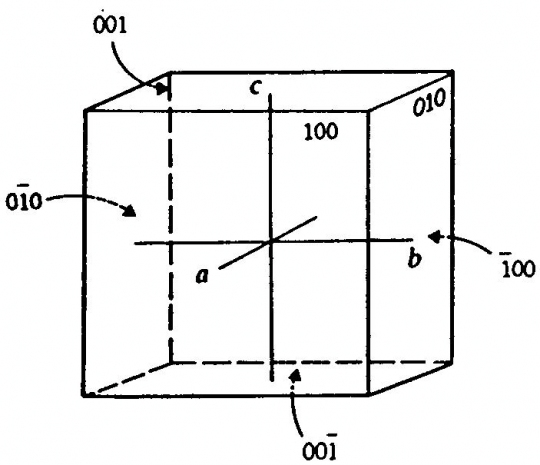
9. ábra. Kristálytani tengelyek a, b, c és a lapok indexei (pl. 001-, -100, stb. l. később)
Paraméter
Azokat a távolságokat, amelyeket az egyes kristálylapok a tengelyekből lemetszenek, paraméternek nevezzük. A kristálylapok jelölésére a paraméterek helyett az ún. Miller féle indexet használjuk. Az indexet a paraméterek reciprok értékei, pl.: (111); (100); (110); stb. Általános esetben a h, k, l, illetve i indexeket alkalmazzuk (9. 10. ábra)
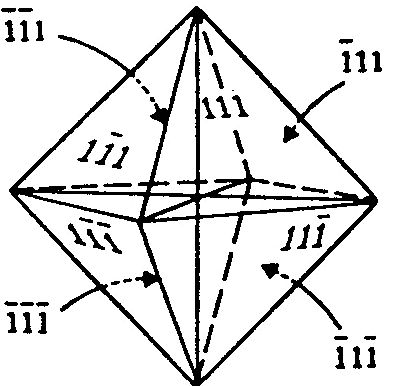
10.ábra. Az oktaéder lapjainak Miller féle indexei
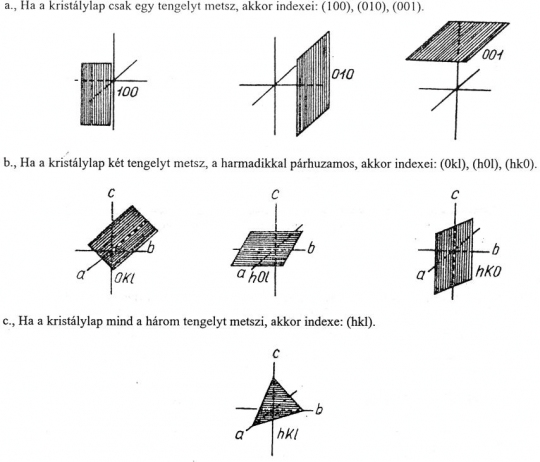
11.ábra. A kristálylapok néhány lehetséges helyzete a tengelykeresztben
Háromhajlású (triklin) rendszer
Háromhajlású (triklin) rendszer
Triklin véglapos osztály: inverziós pont.
Jellemző kristályformák:
véglapok I. véglap (100), II. véglap (010), III. véglap (001);I. fajta véglap (0kl), II. fajta véglap (h0l), III. fajta véglap (hk0), IV. fajta véglap (hkl)
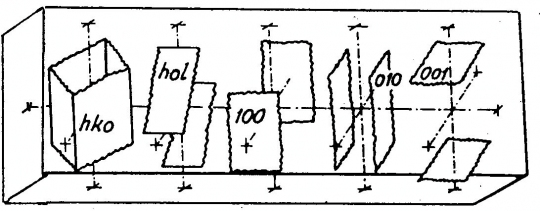
Egyhajlású (monoklin) rendszer
Egyhajlású (monoklin) rendszer
Monoklin prizmás osztály: 1 tükörsík, 1 digír, inverziós pont (29. ábra)

29. ábra.
Jellemző kristályformák: véglap I. véglap (100), II. véglap (010), II. fajta véglap (h0l), III. véglap (001); prizmák I. fajta (0kl), III. fajta (hk), IV. fajta (hkl) (30. ábra).

30. ábra. monoklin prizmák és véglapok
Rombos rendszer
Rombos rendszer
Rombos dipiramisos osztály: 3 tükörsík, 3 digír, inverziós pont (27. ábra)

27. ábra.
Jellemző kristályformák: véglapok I. véglap (100), II. véglap (010), III. véglap (001); prizmák I. fajta (0kl), II. fajta (h0l), III. fajta (hk0); piramisok (hkl); dipiramisok (hkl) (28. ábra).

28. ábra. a, rombos piramis, b, c, d, rombos prizmák, e, f, g, véglapok
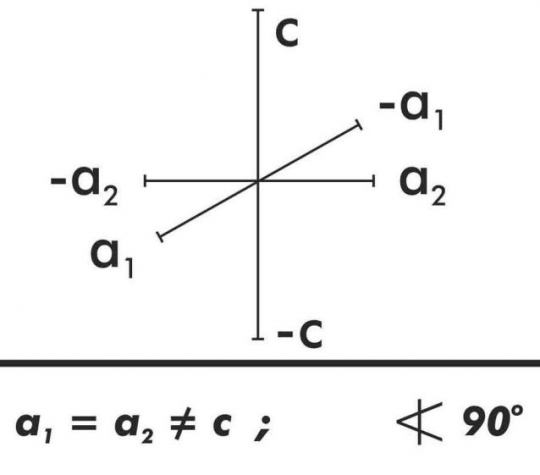
Négyzetes (tetragonális) rendszer
Négyzetes (tetragonális) rendszer
Ditetragonális dipiramisos osztály: 5 tükörsík, 4 digír, 1 tetragír, inverzióspont (23. ábra).

23. ábra.
Jellemző kristályformák: Bázislap (001); Tetragonálios prizmák I.r. (110), II.r. (100);
Tetragonális piramisok I.r. (hhl), II.r. (h0l); Tetragonális dipiramisok I.r. (hhl), II.r. (h0l)
(24. ábra).

24. ábra a, ditetragonális, b, és c, kétféle helyzetű tetragonális dipiramis, d, ditetragonális, e, és f, tetragonális prizmák, g, bázislap végprizmák
Háromszöges (trigonális) rendszer
Romboéderes (trigonális) rendszer 31. ábra. Jellemző kristályformák: prizmák I.r. trg. (101-0); romboéderek I.r. (hoh-l); szkalenoéder (hki-l) (32. ábra).
Ditrigonális szkalenoéderes osztály: 3 tükörsík, 3 digír, 1 trigiroid,1 inverziós pont
(31. ábra)


32. ábra. Különböző helyzetű és hajlású romboéder és egy szkalenoéder
Hatszöges (hexagonális) rendszer
Hatszöges (hexagonális) rendszer
Dihexagonális dipiramisos osztály: 7 tükörsík, 6 digír, 1 hexagír, inverziós pont (25. ábra).

25. ábra.
Jellemző kristályformák: Bázislap (0001); Hexagonális prizmák /I.r. (101-0), II.r. (112-0)/ Hexagonális piramisok /I.r. (h0h-l), II.r. (hh2h-l)/ Hexagonális dipiramisok /I.r. (h0h-l), II.r. (hh2h-l)/ (26. ábra).

26. ábra. a, dihexagonális dipiramis; b, és c, különböző helyzetű hexagonális dipiramisok; d, dihexgonális prizma, hexagonális prizma; e, hexagonális prizma és bázislap (véglap).
Megjegyzés: A tetragonális és a hexagonális rendszerben megkülönböztetünk elsõrendű (I. r.) és másodrendű helyzetet (II. r.) ábra.
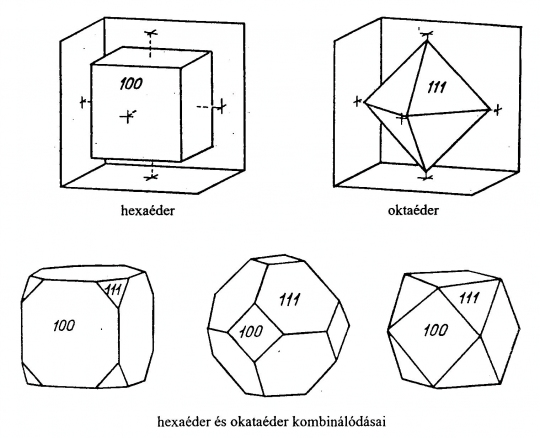
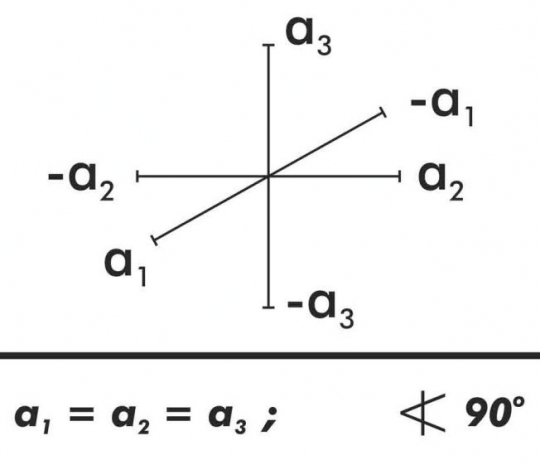
Szabályos (tesszerális) rendszer
Szabályos rendszer. E rendszer szimmetriája a legmagasabb, itt csak a zárt és általában
magas lapszámú formát találunk.
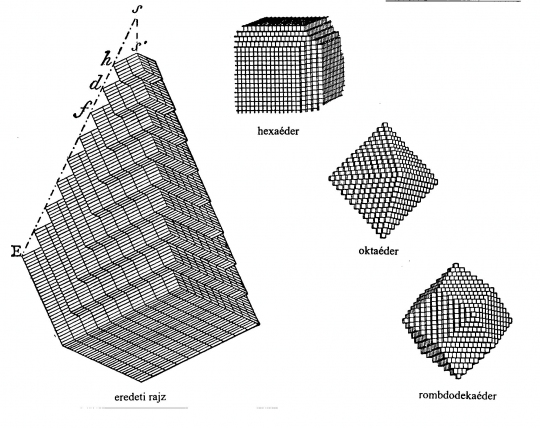
Hexakiszoktaéderes osztály: 3 + 6 tükörsík, 3 tetragír; 4 trigiroid (az ábrán D); 6 digír; inverzióspont (15. ábra).

15. ábra
(100) hexaéder vagy kocka, 6 négyzet alakú lapból áll, szimmetriája a szabályos rendszer
legmagasabb szimmetriájának felel meg (16. ábra).

16. ábra.
(110) rombdodekaéder, vagy rombtizenkettős, 12 rombusz alakú lapból áll.
Lapjaira digír áll merőlegesen. (17. ábra).

17. ábra.
(111) az oktaéder 8 egyenlő oldalú háromszögből áll.
Lapjaira trigiroid áll merőlegesen. (18. ábra)

18. ábra.
Hexakisztetraéderes osztály: 6 tükörsík, 4 trigír (az ábrán D), 3 tetragiroid (19. ábra)

19.ábra
(111) A tetraéder 4 egyenlő oldalú háromszögből áll.
A lapjaira merőleges trigír poláris kifejlődésű. (20. ábra)

20. ábra.
Diszdodekaéderes osztály: 3 tükörsík, 3 digír, 4 trigiroid (az ábrán D), inverziós pont
(21. ábra).

21. ábra.
(hk0) pentagondodekaéder 12 ötszöges alakú lapból áll (22. ábra).
22. ábra.
Kristálykémia
A kristálykémia feladata a belső szerkezet, a külső alak és a fizikai sajátságok közötti összefüggések értelmezése.
Története
A XVIII. sz. második felében a svéd I. Bergmann figyelte meg elsőnek, hogy a kalcit és a kősó ütésre, az ezekre jellemző poliéderekre, "ütési idomokra" hullik. Ennek alapján vezette be R. J. Haüy 1784-ben az ún. dekreszcencia elvet, minek alapján a kristály hézag nélküli, kontinuális illeszkedésű poliéderekből áll, melyek irányoktól függő elrendeződése eredményezi a különböző kristályformákat (33. ábra).
33. ábra. Haüy elképzelése a kristályok felépüléséről
Az elemi cella fogalmát A. Bravais vezette be, mint a kristályrács legkisebb részletét a térrács jellemzésére.
Az elemi cella a kristályrácsnak az a legkisebb része, amelyen belül azonos helyzetű (identikus) tömegpontok nem ismétlődnek (34. ábra).
 34. ábra. Az elemi cella és a kristályrács viszonya
34. ábra. Az elemi cella és a kristályrács viszonya
Az elemi cellát a tömegpontok 3 legrövidebb transzlációs távolságával, az elemi cella élhosszaival jellemezhetjük.
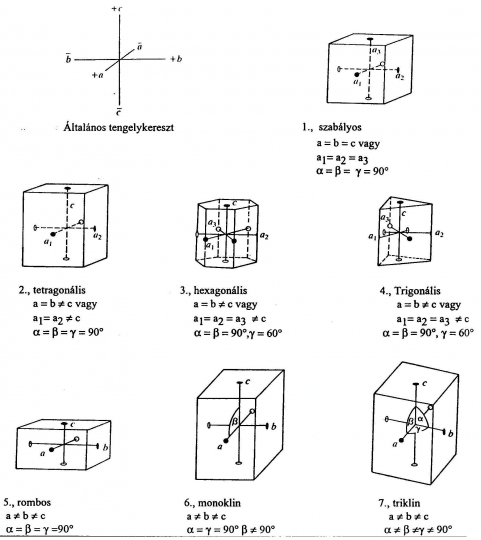
Az elemi cellákon belül 4 alaptípust különíthetünk el:
a., A tömegpontok a cella csúcsain helyezkednek el: egyszerű
b., A tömegpontok a cella csúcsain és a cella alap, ill. felső lapjának közepén
helyezkednek el: alaplapon centrált.
c., A tömegpontok a cella csúcsain és a cella térközepén helyezkednek el: tércentrált.
d., A tömegpontok a cella csúcsain és valamennyi lapjának közepén helyezkednek el: minden lapon centrált, vagy lapcentrált (35. ábra).
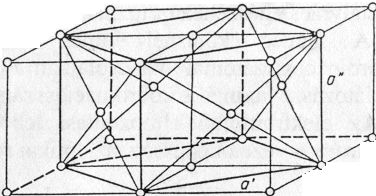
Bravais elméleti megfontolások alapján jutott arra a következtetésre, hogy a kristályokban a részecskék térrácsszerűen helyezkednek el, a részecskéket pedig egyszerűen pontoknak tekintette. Geometriai alapon igazolta, hogy a kristály külső szimmetriájával összhangban, az összes lehetséges kristályrácsok tizennégy féle elemi cellára vezethetők vissza (36. ábra.).
A függelékben, Bravais-féle bizonyítás című részében, a levezetés néhány részlete megtalálható.
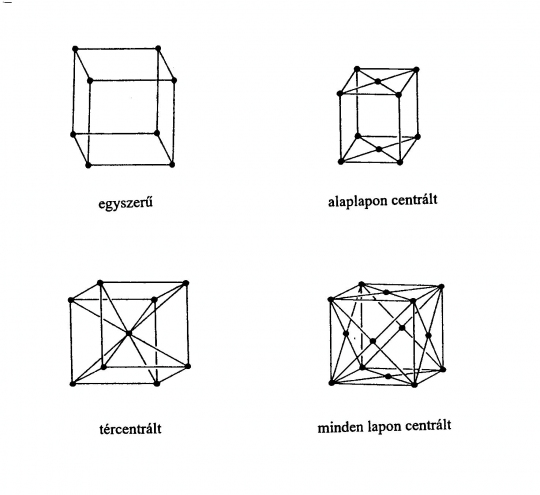 35. ábra. Az elemi cellák négy alaptípusa
35. ábra. Az elemi cellák négy alaptípusa
A Bravais-féle elgondolásokat fejlesztették tovább, és egymástól függetlenül állapítottak meg 230 tércsoportot 1890-ben Frodorov orosz és 1891-ben Schoenflies német kutatók.
Mindezek az elméleti megállapítások kísérleti alátámasztást nyertek 1912-ben, amikor Laue (német) röntgensugarak vizsgálatával bizonyította, hogy a kristályos anyagoknak térrácsszerkezete van (37. ábra).
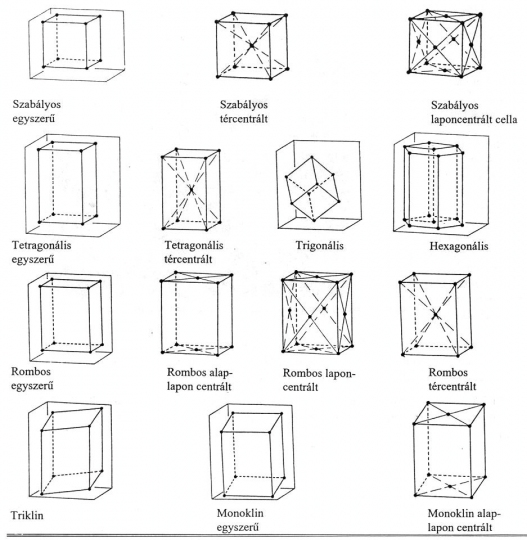
36. ábra. A Bravais-féle tizennégy elemi cella
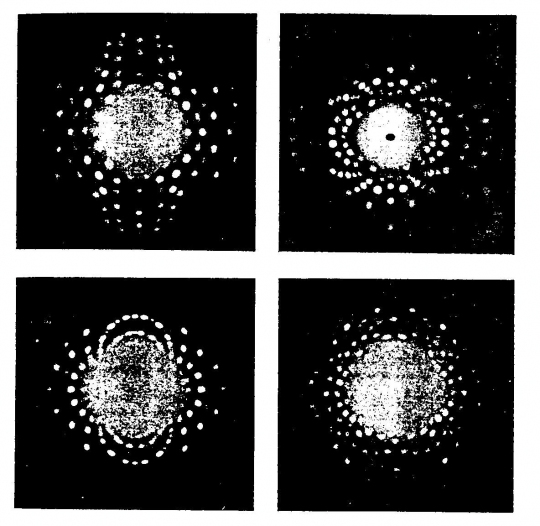
37. ábra. Jellegzetes Laule-féle fényképek
Laue módszerét W. H. Bragg és V. L. Bragg tökéletesítették a kristályokról visszavert sugarakat vizsgálva. További tökéletesítésként a kristály finom porát vizsgálta Debye és Scherrer.
Az elméleti elgondolások helyességének bebizonyosodásával együtt, ismertté vált a rácsban résztvevő részecskék mérete és egymáshoz való viszonya.
A részecskéket összekötő erők sajátságai szerint négy nagy csoportba osztjuk a rácsokat: ionrácsok (döntően ionkötés), atomrácsok (döntően kovalens kötés), fémes rácsok (döntően fémes kötés), molekularácsok (döntően van der Waals erőkkel).
A kristályok növekedése
A növekedés laponként (rétegenként) történik (51. ábra).
Növekedési sebesség: a kristálylapoknak a felületre merőleges irányban történő eltolódásának sebessége
A növekedési sebesség a kristálytanilag különböző irányokban különböző, de egymással párhuzamos irányokban egyenlő.
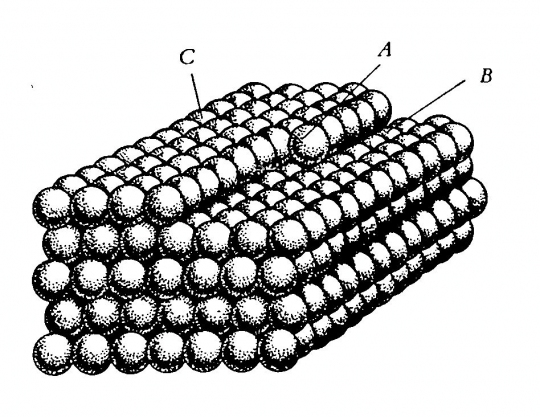 51. ábra. Egy kristálylap kialakulása.
51. ábra. Egy kristálylap kialakulása.
A következő atom főként az A betűvel jelölt helyre törekszik; a C és a B, helyzete kevésbé "vonzó"
A kristályok alakját a lapnormálisok (52. ábra) irányában mért növekedési sebességek aránya határozza meg (53. ábra).
 52. ábra. Egy kristály lapnormálisai
52. ábra. Egy kristály lapnormálisai
A kristályok méretét a gócképződés és gócnövekedés sebességének viszonya határozza meg.
 53. ábra. A kristályalak kialakulása. A gyorsabban növekvő b lap fokozatosan kisebbedik, majd teljesen eltűnik.
53. ábra. A kristályalak kialakulása. A gyorsabban növekvő b lap fokozatosan kisebbedik, majd teljesen eltűnik.
A kristályok növekedését befolyásoló tényezők
a., környezet hatása (bennőtt; fennőtt; ránőtt)
b., koncentráció (54. ábra).
 54. ábra. Az úgynevezett vázkristályok. A hópelyhek olyan közegben jönnek létre, amelyben a víz koncentrációja kicsi, a kristályosodás sebessége pedig nagy. Nincs idő az energiailag legkedvezőbb hely elfoglalására, ezért alakulnak ki vázkristályok.
54. ábra. Az úgynevezett vázkristályok. A hópelyhek olyan közegben jönnek létre, amelyben a víz koncentrációja kicsi, a kristályosodás sebessége pedig nagy. Nincs idő az energiailag legkedvezőbb hely elfoglalására, ezért alakulnak ki vázkristályok.
c., szennyezések (55., 56. ábra).
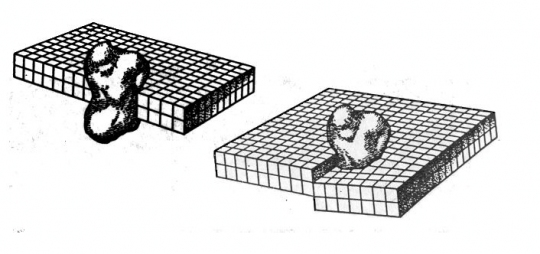 56. ábra. Egy porszem a kristályrácsban.
56. ábra. Egy porszem a kristályrácsban.
(A méretarányok valósághűek.)
A kristályok szabályszerű összenövései (57. ábra)
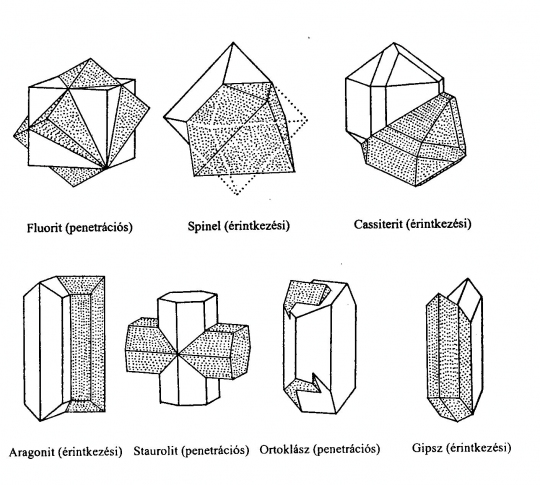 57. ábra. Példák az iker összenövésre
57. ábra. Példák az iker összenövésre
1., Azonos összetétel esetén:
Megkülönböztetünk szimmetrikus (iker) és párhuzamos (az orientáció azonos) összenövést; valamint egyszerű (2 egyed) és többszörös (nagyszámú egyed) összenövést.
Egyszerű összenövés esetén:
a., érintkezési (juxtapoziciós) ikrek (pl.: gipsz; spinell)
b., átnövéses (panetrációs) ikrek (pl.: pirit) (57. ábra
2., Különböző összetétel esetén:
Epitaxis (pl.: CaCO3- NaNO3)
Izotípia
Azokat a kristályokat amelyek hasonló külső alakot és hasonló belső felépítettséget mutatnak, izotip kristályoknak nevezzük (pl.: NaCl, KCl, PbS).
Izomorfia
Azokat az izotip kristályokat, amelyekben az ionok egymást helyettesíthetik (elegykristályokat alkothatnak) izomorfoknak nevezzük. (4.táblázat).
Feltételei:
a., közel azonos méretű tömegpontok,
b., közel azonos polarizációs sajátság,
c., azonos típusú és méretű elemi cella pl.: (CaCO3; NaNO3).
| KALCIT TÍPUS | ARAGONIT TÍPUS | ||||
| Ásvány | Képlete | Kation rádiusz (nm) | Ásvány | Képlete | Kation rádiusz (nm) |
| kalcit (mészpát) | CaCO3 | 0,106 | aragonit | CaCO3 | 0,106 |
| rodokrozit (málnapát) | MnCO3 | 0,091 | stroncianit | SrCO3 | 0,127 |
| smithsonit (cinkpát) | ZnCO3 | 0,083 | cerrusit | PbCO3 | 0,132 |
| sziderit (vaspát) | FeCO3 | 0,082 | witherit | BaCO3 | 0,143 |
| kobaltit | CoCO3 | 0,082 | |||
| magnezit | MgCO3 | 0,078 |
4. táblázat. Példák az izomorf sorokra
Az izomorf vegyületek atomjait, ionjait diadochnak nevezzük, ha viszonylagos nagyságuk és polarizálhatóságuk bizonyos határokon belül egyenlő. A diadoch elemek egymást bizonyos vegyületekben korlátlanul helyettesíthetik. Tökéletesen diadoch a Nb és a Ta [pl.: (Fe,Mn)(Nb,Ta)2O2].
Ha a helyettesítés nem csak egyes alkotókra, hanem a kristály egészére vonatkozik, elegykristályokról beszélünk. 15%-nál kisebb méretkülönbség esetén hézag nélküli, míg ennél nagyobb méretkülönbség esetén (a polarizációs sajátságok változatlan azonossága mellett) hézagos elegykristály-képződésről beszélünk.
Polimorfia (többalakuság):
Az azonos összetételű anyagoknak az a tulajdonsága, hogy különböző termodinamikai feltételek mellett különböző rácsszerkezetben jelennek meg. Elemek esetében allotrópiának nevezzük.
Átalakulás iránya: instabil ® stabil.
Átalakulási pont: az a hőmérséklet, amelyen az átalakulás megtörténik.
Átalakulási sebesség: lassú vagy gyors.
Átalakulás módja: enantiotrop vagy monotrop
1., Enantiotrop: (reverzibilis)
Az egyes módosulatok egy bizonyos hőmérsékleten, ugrásszerűen, a külső alak megváltoztatása nélkül felveszik a másik módosulat kristályrácsszerkezetét.
pl.: α-Fe ¬ 906°C λ-Fe
rombos-S ¬ 96,3°C ® monoklin-S
2., Monotrop (irreverzibilis)
A kristályrács nagyfokú megváltozásával jár, az átalakulás lassú.
pl.: aragonit 400°C ® kalcit
gyémánt 2000°C ® grafit
Pszeudomorfia (álalakúság):
Egy jellegzetesen kristályosodó ásvány kémiai összetétele, kémiai átalakulás következtében fokozatosan megváltozik, az új vegyület azonban "kölcsönveszi" az eredeti kristály alakját.
Pszeudomorfiát létrehozó kémiai átalakulások:
1. Anyagleadás: kuprit (Cu2O) ® réz (Cu)
2. Anyagfelvétel: malachit (Cu2 (OH)2 CO3) ® azurit (Cu3 (CO3)2 (OH)2)
3. Anyagcsere: pirit (FeS2) ® limonit (Fe2O3 . nH2O)
4. Teljes anyagcsere: kvarc (SiO2) ® fluorit (CaF2)
Kémiai kötések
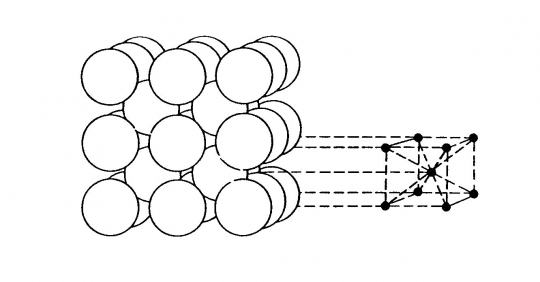
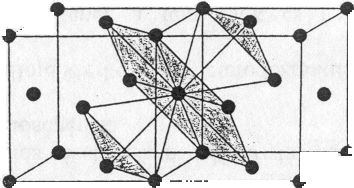
Koordinációs számnak nevezzük azt a számot, amely megmutatja, hogy egy kérdéses tömegpontot hány közvetlenül szomszédos tömegpont vesz körül egyenlő távolságban (38. ábra).
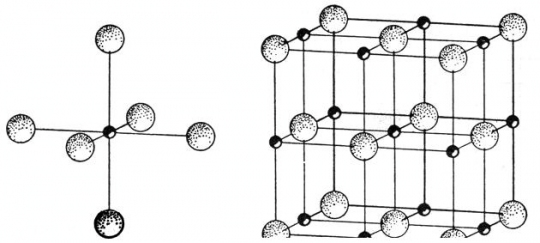 38. ábra. NaCl kristályrács a 6-os koordinációs szám kiemelésével
38. ábra. NaCl kristályrács a 6-os koordinációs szám kiemelésével
Ionrácsok
Az ionvegyületeket elektrosztatikus erők tartják össze. A kristályrács kialakításában három fő tényező érvényesül.
1. Egy központi iont, minél nagyobb számú ellentétes töltésű ion vegyen körül.
2. Az ellentétes töltésű ionok arra törekszenek, hogy egymástól minél nagyobb távolságra rendeződjenek el.
3. A kationra és anionra vonatkoztatott koordinációs számnak a sztöchimertrikus viszonyokkal kell összhangban lennie.
Az ionrácsok fizikai tulajdonságai:
- általában színtelenek.
- vízben és poláris oldószerekben jól oldódnak.
- nem vezetők, de olvadékuk és oldatuk az elektromos áramot jól vezeti.
- fénytörésük közepes.
- a keménység, olvadáspont, forráspont az ionok közötti távolsággal fordítottan arányos.
A. Izodezmikus szerkezetek (amelyekben az ionok között mindenhol azonos erõsségű kötőerők hatnak).
AB típus:
Cézium-klorid (CsCl)
Felépítése: 2 szabályos egyszerű cella, amelyek egy fél testátlóval vannak egymásba tolva. A Cs+ kationok az így létrejött cella csúcsain, a Cl- anionok a cella közepén helyezkednek el.
Koordinációs szám: [8]
Kötésmód: hexaéderes (39. ábra)
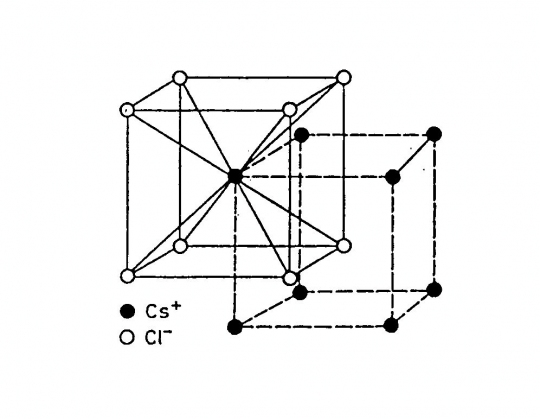 39. ábra. Cézium-klorid rács
39. ábra. Cézium-klorid rács
(Ilyen típusú rácsban kristályosodik a cézium-bromid (CsBr) és a cézium jodid (CsI) is.)
Nátrium-klorid, kősó (NaCl)
Felépítése: 2 szabályos lapcentrált cella, amelyek fél cellaéllel vannak egymásba tolva. Ennek következtében a Na+ kationok a cella csúcsain és lapközepein, a Cl- anionok az élek felezőpontjában és a cella közepén helyezkednek el.
Koordinációs szám: [6]
Kötésmód: oktaéderes (40. ábra)
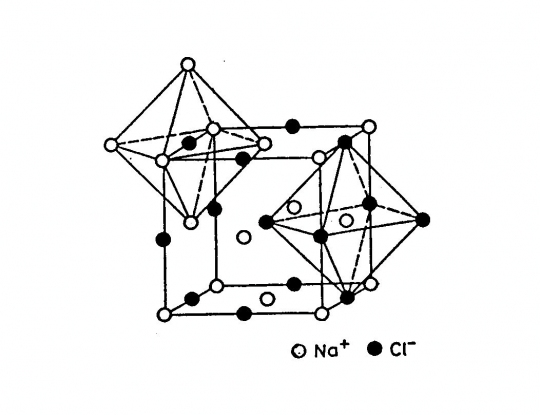 40.ábra. NaCl rács
40.ábra. NaCl rács
(Kősó típusú rácsa van a szilvinnek (KCl), a galenitnek (PbS), az alabandinnak (MnS), és a periklásznak (MgO) is.)
AB2 típus:
Fluorit (CaF2)
Felépítése: 3 szabályos lapcentrált cella, amelyek a cellaél felével, ill. a testátló negyedével vannak egymásba tolva. A Ca2+ kationok a cella csúcsain és lapközepein, a F- anionok az 1/8 részkockák közepén helyezkednek el.
Koordinációs szám: Ca2+ F- ® [8], F- Ca2+ ® [4]
Kötésmód: hexaéderes ill. tetraéderes (41. ábra).
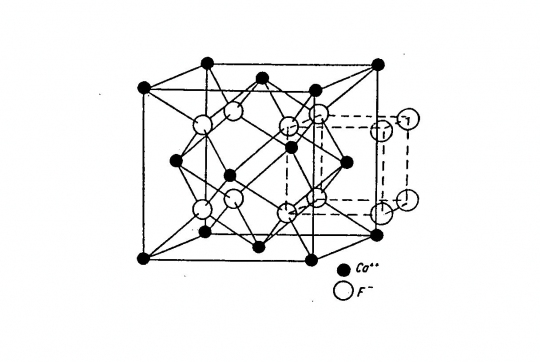 41. ábra. CaF2-rács.
41. ábra. CaF2-rács.
(Fluorit szerkezeti típusa van az uránszurokércnek (UO2) is, antifluorit rácsa például az argentitnek (Ag2S).)
B. Mezodezmikus szerkezetek (a szilikátok szerkezete).
A szilikátok a földkéreg legelterjedtebb ásványai, ré¥gebben a feltételezett hipo-, orto-, metakovasavak sóinak tekintették. A szilikátok alapeleme az (SiO4)4- -gyök, ahol a Si4+ -t tetraéderesen négy O2- környékezi. A (SiO4)4- -gyökök 1-1 oxigén révén kapcsolódhatnak egymáshoz, vagy a szabad vegyértékeikkel kationokat kötnek le. Ily módon az (SiO4)4- -gyökök csoportokban, végtelen láncokban, síkrácsokban, vagy térhálókban illeszkednek az alábbi módon:
1. Sziget, vagy nezoszilikátokban önálló (SiO4)4- tetraéderek vannak, amelyeket általában két és három vegyértékű kationok kompenzálnak. Pl.: olivin (Fe, Mg) SiO4 , gránát-félék stb.
2. Csoport vagy szoroszilikátokban 2, 3, 4, 6 (SiO4)4- tetraéder 1-1 O2- révén kapcsolódik egymáshoz, (SiO2O7)6- , (SiO3O9)6- , (SiO4O12)8- , (SiO6O18)12- alapképlettel. A nezo- és szoroszilikátok nagy keménységű és fénytörésű ásványok, a "drágakövek" nagy része ilyen szerkezetű.
3. Lánc- és szalag, v. inoszilikátok az (SiO4)4- tetraéderek 2 O2-, ill. 4 O2- révén (Si2O6)4- láncot, ill. ¥ (Si2O11)6- szalagot alkotnak. Képviselői a piroxének és az amfibólok.
4. Fillo-vagy réteg szilikátok: a (SiO4)4- tetraéderek 3-3 oxigénje közös. Az alapképletük (Si4O10)4-. Ide soroljuk a csillámokat (pl. biotit, muszkovit).
5. Ásvány- térhálós vagy szilikátok az (SiO4)4--gyök három irányban mind a 4 O2--el kapcsolódik a szomszédos tetraéderhez, Ilyen a kvarc és módosulatai, valamint a magmás kőzetek leggyakoribb ásványa, az ortoklász és plagioklász (* földpátok) (42. ábra).
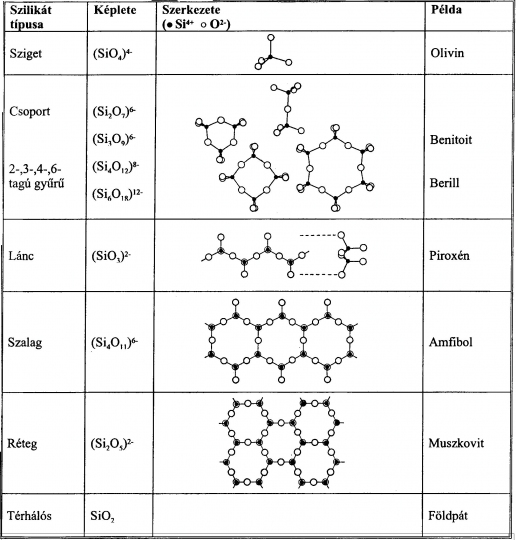 42. ábra. SiO2 tetraéderek kapcsolódásának módja
42. ábra. SiO2 tetraéderek kapcsolódásának módja
C. Anizodezmikus szerkezetek, amelyekben az ionok önálló csoportként önálló építőegységként jelennek meg.
Kalcit (CaCO3)
Ha a kősó elemi celláját az egyik trigiroid irányban állítjuk fel úgy, hogy a cellaélek által bezárt szög 102° /tehát nem 90°/ legyen, és minden Na+ kation Ca2+ kationnal és minden Cl- aniont karbonátionnal (CO32-) helyettesítünk, megkapjuk a hasadási romboéder elemi celláját.
A CO32- anionok planáris elrendeződésűek, a cellaélek közepén és a cella térközepén síkjukkal a (0001) indexű rácssíkokkal párhuzamosan helyezkednek el. A cella csúcsait és lapközepeit a Ca2+ kationok foglalják el.
Koordinációs szám a kősó rácshoz hasonlóan. [6] (43. ábra)
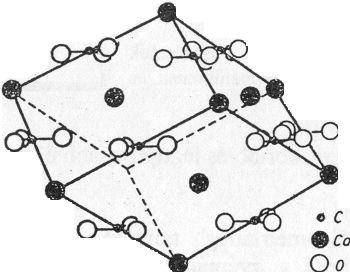 43. ábra. Kalcit-rács
43. ábra. Kalcit-rács
(A kalcittal egyező típusú szerkezete van a rodokrozitnak (MnCO3), a smithsonitnak (ZnCO3), a szideritnek (FeCO3), a magnezitnek (MgCO3) és a chilei salétromnak (NaNO3) is.)
Aragonit (a rombos CaCO3).
Atomrácsok
Az atomokat kovalens kötés tarja össze.
Jellemzői:
1. A kötésszög iránya 180°-nál kisebb is lehet.
2. Csak a periódusos rendszer IV. oszlopában van meg a lehetőség arra, hogy az elemek atomjai háromdimenziós rácsot hozhassanak létre.
3. A koordinációs számot, a meglévő vegyértékviszonyok korlátozzák.
4. Intenzitásban a kovalens kötés lényegében nem különbözik az ionos kötéstől.
5. Elektromos vezetőképesség szempontjából az atom- és ionrácsok alapvetően különböznek egymástól. Az atomrácsos kristályok olvadék állapotban sem vezetik az elektromos áramot.
Gyémánt (C)
Felépítése: cellája két szabályos minden lapon centrált elemi cellából vezethető le, amelyek a testátló negyedével vannak egymásba tolva. Az egymásbatolás eredményeként a szénatomok a szabályos lapcentrált cella csúcsain, lapközepén és a váltakozó térnyolcadok közepén helyezkednek el.
Koordinációs szám: [4]
Kötésmód: tetraéderes (44. ábra)
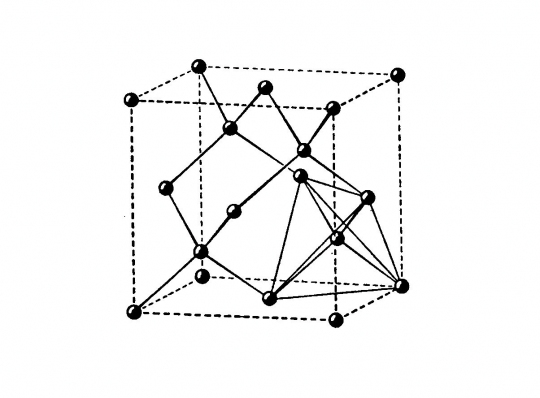 44. ábra. Gyémántrács
44. ábra. Gyémántrács
(Ilyen típusú szerkezete van az elemek közül a szilíciumnak, germániumnak és az ónnak is.)
A gyémánt leggyakoribb és legtípusosabb növekedési alakja, kristályformája, az oktaéderlap.
Szfalerit (ZnS)
Felépítése: Geometriailag teljesen azonos felépítésű a gyémántráccsal. A különbség az, hogy az egyik lapcentrált cellában a szénatomok helyét a cinkatomok, a másik lapon centrált cellában kénatomok foglalják el (45. ábra).
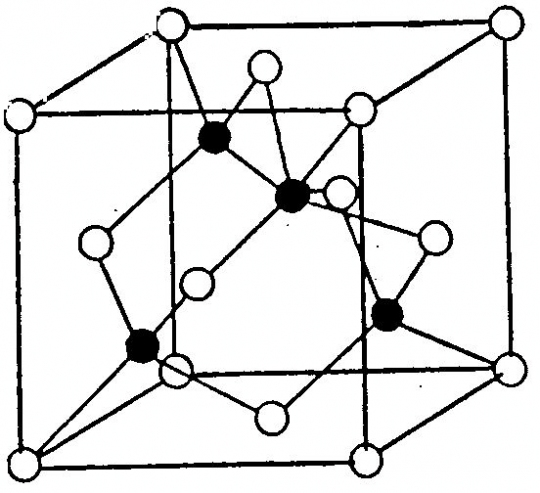 45. ábra. Szfalerit-rács
45. ábra. Szfalerit-rács
(A szfaleriten kívül ilyen típusú rácsa van az ércásványok közül a metacinnabaritnak (HgS),a tiemannitnak (HgSe), a koloradoitnak (HgTe). Közel áll a szfalerit-rácshoz a wurtzit-rács, különbség, hogy a két szomszédos koordinációs tetraéder a szfaleritnél inverzióspont szerint, a wurtzitnál tükörsík szerint kapcsolódik össze.)
Fémrács típusok
A fémes kötés a jellemző.
Sajátságai:
1. A vegyértékelektronok nem lokalizálódnak a szomszédos atomok közé, hanem a kristályrács egészéhez tartoznak.
2. A fémes kötésnél nincs kitüntetett irány. A kötés gömbszimmetrikus. A koordinációs számmal kapcsolatban a fémes rácsoknál nincs sem térbeli, sem számbeli korlátozás. Maximális koordinációs számok alakulhatnak ki.
3. Az elektronfelhő elmozdulási lehetőségével kitűnően értelmezhető a termikus és az elektromos vezetőképesség, az optikai sajátság, nagy reflekcióképesség.
1/ Szoros értelemben vett fémrácsok (homodezmikus szerkezetek)
a/ Szabályos szoros illeszkedésű rács (réz-típus):
Minden egyes fématomot saját síkjában, egyenlő távolságban 6 /vele egyező nagyságú/ atom vesz körül. Az említett atom felett és alatt, szintén egyenlő távolságban, 3-3 atom egymáshoz képest 60°-kal van elforgatva.
Minden harmadik sík azonos helyzetű, s a szoros illeszkedés síkjára merőlegesen inverziós trigiroidot találunk. A szoros illeszkedés síkjának a (111) indexű rácssíkok, azaz az oktaéderlapok felelnek meg. A szabályos lapcentrált cellában kristályosodó fémek az oktaéderlapok mentén, tehát 4 irányban siklathatók és ezért kitűnően nyújthatók, megmunkálhatók.
A kationok által kitöltött tér a kristályrács egész térfogatához képest 74%.
Koordinációs szám: [12] (46. ábra)
 46. ábra. Szabályos szoros illeszkedésű rács (pl. Cu, Ag, Au, Pt, *-Fe)
46. ábra. Szabályos szoros illeszkedésű rács (pl. Cu, Ag, Au, Pt, *-Fe)
b/ Szabályos tércentrált rács (wolfram-típus):
Az atomok által kitöltött tér a kristályrács egészéhez képest 68%. A szabályos tércentrál cellával rendelkező fémek fizikai sajátságai nem olyan kedvezőek, mint a szabályos, szoros illeszkedést mutató fémek esetében. Nincs kitüntetett siklatási irányuk. Kevésbé megmunkálhatók, nyújthatók, merevebbek. Példa erre a tércentrált cellás alfa-Fe és lapcentrált cellás gamma-Fe eltérő viselkedése. Előbbi rosszul, utóbbi kitűnően nyújtható. 906°C-on az alfa-Fe ugrásszerűen gamma-Fe-sá alakul. A vasat azért kell megmunkálás, hengerlés előtt a vörös izzás hőmérsékletére emelni, hogy ez az átalakulás végbemenjen.
Koordinációs szám: [8] (47. ábra).
 47. ábra. Az alfa-vas gamma-vassá történő átalakulásának szerkezeti magyarázata
47. ábra. Az alfa-vas gamma-vassá történő átalakulásának szerkezeti magyarázata
(A W, Li, Na, K, Mo-re is ilyen cella jellemző.)
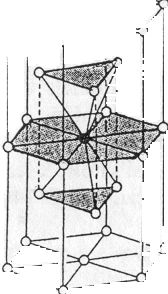
c/ Hexagonális szoros illeszkedésű rács (magnézium-típus):
Minden tömegpontot saját síkjában 6 vele egyező nagyságú tömegpont vesz körül egyenlő távolságban. A központi atom felett és alatt egyenlő távolságban 3-3 tömegpont helyezkedik el. A felső és alsó tömegpontok egymáshoz képest nincsenek 60°-kal elforgatva. Ennek következtében minden második sík helyzete azonos és a szoros illeszkedés síkjára merőleges egy hexagír. A szoros illeszkedés síkja (0001) kristálylapnak felel meg.
Ennek következtében a hexagonális rendszerű fémek a bázislap szerint siklathatók és ezért nyújthatók, megmunkálhatók, bár nyújthatóságuk a szabályos lapcentrált cellájú fémekét nem éri el.
Koordinációs szám: [12] (48. ábra)
 48. ábra. Hexagonális szoros illeszkedésű rács (Mg, Zn, Cd, Ti)
48. ábra. Hexagonális szoros illeszkedésű rács (Mg, Zn, Cd, Ti)
Az azonos rácstípusban való kristályosodás alapja a fémek egymással való elegyedésének, ötvözhetőségének.
2/ Metalloid szerkezetek (heterodezmikus szerkezetek)
Grafit
Átmenetet képez a fémrácsok és a molekularácsok között. Jellegzetes kétdimenziós, rétegrácsos szerkezete van. A bázislapokkal párhuzamosan nem csak a hőt és az elektromosságot vezeti kitűnően, hanem ugyanezzel a síkkal párhuzamosan kitűnő transzlációs sajátságot mutat. Ezen alapul ceruzaként való használata. A C-atomok hatos gyűrűket képeznek, a hatos gyűrűk síkja a (0001) lapnak megfelelő rácssíkkal párhuzamos. A szomszédos szénatomok távolsága a rácssíkban 0,142 nm.
A szomszédos rácssíkok egymástól való távolsága 0,335 nm. A hatos gyűrűk minden páros síkban egymás alatt helyezkednek el (49. ábra).
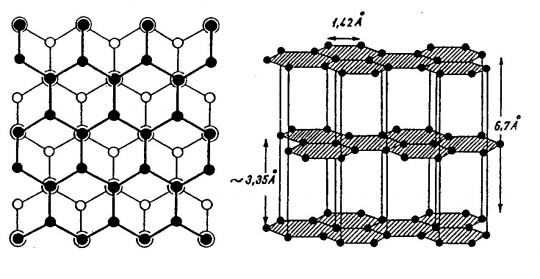 49. ábra. Grafitrács
49. ábra. Grafitrács
Molekularácsok
Olyan heterodezmikus szerkezetek, amelyekben a tömegpontok helyét molekulák foglalják el.
A molekulák közötti kötést a gyenge van der Waals-féle erők, indukciós vagy diszperziós erők biztosítják. Az intermolekuláris erők mindig sokkal gyengébbek, mint a molekulán belüli (intramolekuláris) erők. Így a molekularácsoknál az összetartó erő és a rácsenergia csekély.
Keménységük kicsi, olvadás- és forráspontjuk alacsony, összenyomhatóságuk nagy. Párolgás- és olvadáshőjük alacsony. Háromdimenziós, kétdimenziós és egydimenziós szerkezeteket különböztetünk meg.
Széndioxid (CO2):
Felépítése: szabályos lapcentrált cella, amelyben a tömegpontok helyét CO2 molekulák foglalják el.
Koordinációs szám: [12] (50. ábra)
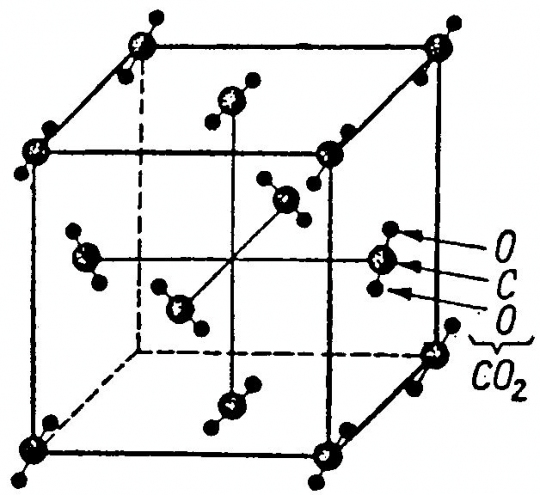 50. ábra. A szén-dioxid molekularácsa
50. ábra. A szén-dioxid molekularácsa
(Ilyen a rácsa még a kénnek, SiF4-nak és szinte minden szerves vegyületnek.)
Kristályfizika
Tartalom
Sűrűség
Sűrűségen értjük a térfogategységben foglalt tömegmennyiséget. A sűrűség mértékegysége SI egységben kg/m3 vagy kg*m-3, jele: ρ.
A sűrűség elsősorban az ásványokat alkotó atomok és ionok tömegétől, másodsorban azok rácsszerkezeti elrendezésétől függ.
Szilárdsági tulajdonságok
Rugalmasság
Minden olyan testet rugalmasnak nevezünk, amely az alakját megváltoztató külső erő megszünése után visszanyeri eredeti geometriai alakját.
Hasadás, törés
Az elválásnak azt a formáját, amikor hirtelen mechanikai hatásra a részekre szakadás (törés) sík lapok mentén történik, hasadásnak nevezzük.
Az azonos tömegpontokból felépített kristályoknál a kohézióminimumra merőlegesen következik be (a tömegpontokkal sűrűn terhelt síkok mentén.)
Az egyes ásványokra jellemző a hasadás minősége. Vannak:
-
kitűnően v. tökéletesen hasadó ásványok (pl. csillámok, gipsz, kalcit, galenit, fluorit),
-
jól (pl. földpátok),
-
valamint rosszul v. tökéletlenül hasadó ásványok (pl. gránát, berill, cirkon, turmalin).
A nem hasadó ásványokból minden esetben, a hasadó ásványok törése esetén, ha az nem a hasadási irányban történik, törésfelületet kapunk. Ezt a mechanikus hatás következtében történő részekre válást törésnek nevezzük. A törést a keletkező felületek és törési felszínek alapján csoportosíthatjuk:
-
egyenes (pl. jáspis)
-
kagylós (pl. malachit. opál)
-
földes (pl. bauxitásványok, limonit)
-
szilánkos (pl. tűzkő, nefrit)
-
horgas (pl. fémek)
-
egyenetlen (pl. kvarc, berill, kalkopirit).
Keménység
Mechanikai behatásokkal (karcolás, fúrás, csiszolás) szemben mutatott ellenállás.
A keménység legszorosabb összefüggésben a kémiai kötéstípussal (erősségével emelkedik) és a kristályszerkezettel van (a tömegpontok egymástól való távolságával fordítottan arányos).
Az egyes osztályokon belül általánosságban a következők mondhatók el:
- az elemeknek kicsi vagy közepes a keménysége (a fémrácsú elemeknek a transzlációs síkok miatt;
- a szulfidok kis- és közepes keménységűek (a kén viszonylag nagy ionrádiusza miatt);
- az oxidok általában kemények;
- a szilikátok 5-7 keménységűek, közöttük a sziget- és csoportszilikátok a legkeményebbek;
- a foszfátok 3-5 keménységűek;
- a szulfátok kis keménységűek;
- a karbonátok keménysége valamivel nagyobb a szulfátokénál (mert a karbonátion a szulfátionnál kisebb);
- a halogénvegyületek lágyak (a Cl-, Br-, I- nagy ionrádiusza miatt);
- a szerves vegyületek kis keménységűek (mivel molekularácsúak).
A keménység megadására leggyakrabban a Mohs-féle keménységi skálát alkalmazzák. Alapja az ún. kapcsolási keménység, amely azt mutatja meg, hogy melyik ásvány karcolja a másikat.
|
Keménységi fok |
Ásvány neve |
Összetétel |
|
1 |
Mg3(Si4O10)(OH)2 |
|
|
2 |
CaSO4*2H2O |
|
|
3 |
CaCo3 |
|
|
4 |
CaF2 |
|
|
5 |
Ca5(PO4)3(Cl, F,OH) |
|
|
6 |
KAlSi3O8 |
|
|
7 |
SiO2 |
|
|
8 |
Al2(SiO4)(F,OH)2 |
|
|
9 |
Al2O3 |
|
|
10 |
C |
Fénytani (optikai) tulajdonságok
A kristályon áthaladó, vagy visszaverődő fényt tanulmányozzuk.
Átlátszóság
Az ásványok a rajtuk keresztülhaladó fényt különböző mértékben eresztik át. Lehetnek:
a., átlátszók (pl. izlandi pát, hegyi kristály)
b., áttetszők (pl. tejkvarc)
c., átlátszatlanok v. opák (elsősorban a fémek és a fémes ráccsal rendelkező egyéb ásványok).
Fénylés
Az ásvány felületéről visszavert fény mennyisége és minősége határozza meg, valamint függ a rácstípustól.
a., fémfényűek (visszaverődés 15-97 %-os) (pl. termés fémek);
b., félfémfényűek (visszaverődés 20-25 %-os) (pl. rutil TiO2, hematit Fe2O3);
c., gyémántfényűek (visszaverődés 10-20 %-os) (pl. gyémánt, cerruszit PbCO3);
d., üvegfényűek (visszaverődés 4-10 %-os) (általában a periódusos rendszerben a vas előtt található elemek kovalens kötésű vegyületei, így a szilikátok többsége);
e., zsírfényűek (visszaverődés < 4 %-os) (pl. nefelin (K,Na)AlSiO4);
f., gyöngyházfény (rétegrácsos szilikátok mutatják, a lapok közé bekerülő levegő miatt, például a talk Mg3Si4O10(OH)2, a dolomit CaMg(CO3)2 és a gipsz CaSO4 2H2O hasítási felülete is);
g., selyemfény (inkább a felülettől függ, mint a belső szerkezettől, pl. a szálas, rostos kifejlődésű gipsz mutatja, a rostok közé bekerülő levegő miatt);
h., fénytelenek (a földes szerkezetű anyagok, pl. kaolin).
Szín (oka: a fehér fény bizonyos hullámhosszainak szelektív abszorpciója)
a., saját színű ásványok [a bennük előforduló színes ionok vagy molekulák miatt, pl. vas-, mangán-, króm-, rézionok: kék, zöld (azurit, malachit); Fe3t-ionok: vörös-sárga-barna (hematit, vas-okker félék);Mn2t-ionok: rózsaszínűek (rodokrozit)]. Poruk is mutatja az ásvány színét (mázatlan porcelánon vonalat húzva állíthatjuk elő finom porukat ® jellemző karcszín);
b., színezett ásványok (az ásvány anyagához hozzákeveredett idegen anyagok miatt, pl. a kvarc színes változatai, vagy az ortoklósz vörös színe a finom eloszlású hematittól; az amelitet mangánionok színezik, a zöld berillt pedig a króm). Poruk fehér vagy szürke.
Fénytörés
Vektoriális sajátság. Az optikailag izotróp ásványok (szabályos rendszer, amorf) mutatják.
Az ásvány törésmutatója:
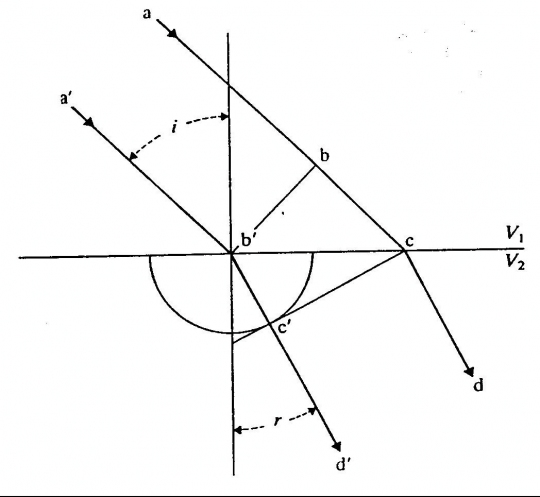 Fénytörés.
Fénytörés.
(i a vákuumból jövő sugárnak a beesési merőlegessel bezárt szöge, r a törés utáni sugárnak a beesési merőlegessel alkotott szöge.)
Kettőstörés
A fénytörésnek az az esete, amelyet az optikailag anizotróp ásványok (mind, a szabályos rendszerűeket kivéve) mutatnak.
Az optikailag anizotróp ásvány felületére nem merőlegesen eső fény két sugárra bomlik. Az egyik megtörik, a másik nem.
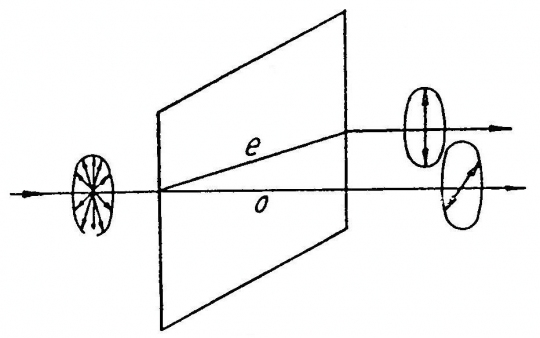 A kettőstörés optikai magyarázata
A kettőstörés optikai magyarázata
A megtört sugár az extraordinárius sugár (rendkívüli, mert nem érvényes rá a fénytörés törvénye), a másik az ordinárius sugár. Egymásra merőlegesen polarizáltak, és a rájuk vonatkoztatott törésmutatók is eltérők. Ez határozza meg a kettőstörés nagyságát, amely ásványfajtánként különböző.
Ásványfajtán belül iránytól függ a kettőstörés nagysága, és található olyan irány (egy vagy kettő), amelyben nincs kettőstörés.
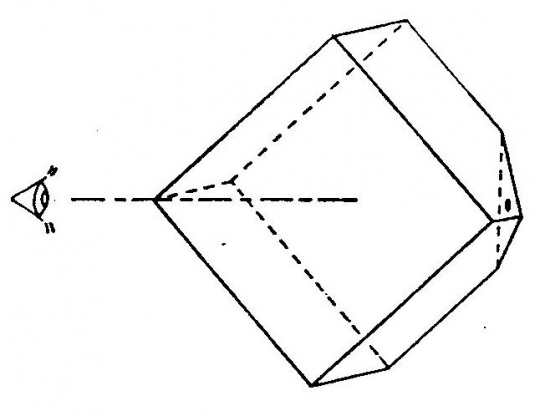 Optikai tengelynek nevezzük azt az irányt, amelyben az ásvány optikai anizotrópiája ellenére nincs kettőstörés
Optikai tengelynek nevezzük azt az irányt, amelyben az ásvány optikai anizotrópiája ellenére nincs kettőstörés
Az optikai tengelyek számát az határozza meg, hogy az illető ásvány főtengelyes rendszerben kristályosodik-e:
a., egy optikai tengelyűek
- hexagonális rendszerűek,
- trigonális rendszerűek,
- tetragonális rendszerűek;
b., két optikai tengelyűek
- rombos rendszerűek,
- monoklin rendszerűek,
- triklin rendszerűek.
Lumineszcencia
Ha valamely ásvány, egy bizonyos formában felvett energiáját a látható fény tartományában bocsátja ki, lumineszcenciáról beszélünk.
A gerjesztő energia jellegétől függően osztályozzuk a lumineszcencia-jelenségeket:
a., fotolumineszcencia (fénygerjesztéssel)
- fluoreszcencia (az ásvány csak addig lumineszkál, amíg a besugárzás tart, pl. fluorit CaF2, scheelit CaWO4);
- foszforeszcencia (a lumineszcencia a besugárzás után is tart, 10-8 s-tól akár órákig).
b., termolumineszcencia (hőhatásra bekövetkező fénykibocsátás, pl. topáz, gyémánt, kalcit)
c., tribolumineszcencia (dörzsölés, csiszolás hatására fénykibocsátás, pl. szfalerit ZnS).
Mágneses tulajdonságok
Diamágneses (nem mágnesezhető, a mágnes taszítja; pl. kalcit, kvarc, kősó).
Paramágneses (átmenetileg mágnesezhető; pl. sziderit, limonit, hematit, berill).
Ferromágneses (oly nagy mértékben paramágneses, hogy maga is lehet aktív mágnes; pl. mágnesvasérc Fe3O4). Nem az anyag, hanem a kristályrács jellegzetessége. Ha a szerkezet megváltozik, megváltozik a mágneses sajátság is.
Elektromos tulajdonságok
Vezetőképesség
A kristályrács típusától függő vektoriális sajátság: a fémrácsú ásványok vezetőképessége nagyságrendekkel jobb, mint a nemfémek, és azok vegyületeinek vezetőképessége (pl. ezüst-kvarc 1020-szoros különbség).
Piezoelektromosság
Egyes nem vezetőképes kristályokat bizonyos irányban összenyomva, ellentétes végük ellentétes töltést nyer . Húzás hatására a pólusok felcserélődnek. Csak olyan kristályokban fordulhat elő, amelyekben nincs szimmetria-középpont (pl. kvarc).
Piroelektromosság
Az ásvány melegítés hatására válik valamely irányban elektromosan polárossá. Szintén csak szimmetriaközpont nélküli kristályokban lép fel (pl. turmalin).
Ajánlott linkek és könyvek
Ásvány
Kristály
Ásványianyag
A Magyar Állami Földtani Intézet honlapja
Angol nyelvű geológiai weblap
Greenfo - Zöld iránytű a neten
Hókristályok kristálytisztán (angol nyelvű)
http://www.its.caltech.edu/~atomic/snowcrystals/
Képgalériák
http://tasaclips.com/photos.html
http://commons.wikimedia.org/wiki/Category:Minerals
http://commons.wikimedia.org/wiki/Category:Gemstones
http://wannenkopfe.strahlen.org/minerals.html
http://www.exceptionalminerals.com/
http://www.wilenskyminerals.com/
http://www.johnbetts-fineminerals.com/
http://monstone.hu/Asvany/asvany.html
http://www.hungarianachat.hu/index.html
http://www.schefferj.ps.hu/Minerals.htm
Könyvek
Koch Sándor - Sztrókay Kálmán Imre: Ásványtan I. II.
http://mek.oszk.hu/04700/04799/
Dudichné Vendl Mária - Koch Sándor: A drágakövek, különös tekintettel a mesterséges drágakövekre
http://mek.oszk.hu/03000/03090/index.phtml
Koch Sándor: Magyarország ásványai
http://mek.oszk.hu/04700/04793/index.phtml
Kerényi Attila: Környezettan. Természet és társadalom - globális nézőpontból, Mezőgazda Kiadó, Budapest 2003
Kerényi Attila: Általános környezetvédelem, Mozaik Oktatási Stúdió, Szeged 1995
Fülöp József: Az ásványi nyersanyagok története Magyarországon, Műszaki Könyvkiadó, Budapest 1984
John Farndon: Kőzetek és ásványok képes enciklopédiája, Atheneum 2000, Budapest 2007
Papp Sándor, Rolf Kümmel: Környezeti kémia, Veszprémi Egyetemi Kiadó, Veszprém 2005
Bognár László: Ásványhatározó, ELTE Eötvös Kiadó, Budapest 1999
Römpp: Vegyészeti Lexikon, Műszaki Könyvkiadó, Budapest 1981
Ásványok rendszerezése
Az ásványok rendszerezésének alapját mindig a geológia tudományágainak fejlettsége határozta meg. A ma leginkább elfogadott rendszerezési alap az ásványok kémiai összetétele alapján IX. ásványosztályt különböztet meg.
I. Terméselemek
"Jelenleg közel 100 terméselemet és rokon vegyületet ismerünk ásványként, mennyiségük azonban nem haladja meg a földkéreg tömegének 0,1%-át. A terméselemek és rokon vegyületek roppant változatos szerkezettel és kötéstípusokkal rendelkeznek. A fémek viszonylag egységes szerkezetűek, melyekre zömmel a legtömöttebb illeszkedés, illetve a fémes kötés jellemző. A félfémek minden szempontból átmenetet képeznek a nemfémek irányába. A nemfémek szerkezetében részben kovalens kötés (szén módosulatai), részben van der Waals kötés ismert (kén és rokon elemek). Amíg a fémek fémes rácsot alkotnak, addig a nemfémek atomrácsot, és molekularácsot egyaránt. A szorosan vett terméselemek mellett ebbe az osztályba tartoznak az intermetallikus vegyületek (ötvözetek), illetve a karbidok, szilicidek, nitridek és foszfidok."
Szakáll Sándor
Termésarany
|
Név |
termésarany |
|
Vegyjel, képlet |
Au |
|
Ásványosztály |
terméselemek |
|
Kristályrendszer |
szabályos |
|
Kristályalak |
ritka kristályai aprók, rendszerint hexaéderesek vagy oktaéderesek, többnyire szemcséket vagy rögöket alkot, illetve drótszerűen szerteágazó kristályhalmazokat |
|
Szín |
aranysárga |
|
Fény |
fémes |
|
Karc |
aranysárga |
|
Keménység (Mohs-féle) |
2,5-3 |
|
Hasadás |
nincs |
|
Törés |
horgos |
|
Sűrűség |
19,3 g/cm3 |
|
Keletkezés |
pemagmatitos v. hidrotermás |
|
Fontosabb lelőhely |
Magyarország (Telkibánya, Recsk), Szlovákia (Selmecbánya, Körmöcbánya), Románia (Verespatak, Zalatna), Oroszország, Dél-Afrika (Witwatersrand), Indonézia (Grasberg), Ausztrália (Bendigo & Ballarat, Finders Range), USA (Yukon, Kalifornia, Colorado, Dél-Dakota), Kína, világtengerek (kb.: 1 trillió tonna) |
|
Egyéb jellegzetesség |
nyújtható, kalapálható és vágható |



Forrás: http://www.minerapole.com/
Termésezüst
| Név | termésezüst |
| Vegyjel, képlet | Ag |
| Ásványosztály | terméselemek |
| Kristályrendszer | szabályos |
| Kristályalak | drótszerű, szerteágazó tömegek vagy szemcsék, vagy ritkábban köbös kristályok |
| Szín | ezüstfehér, de gyorsan megfeketedik |
| Fény | fémes |
| Karc | ezüstfehér |
| Keménység (Mohs-féle) | 2,5-3 |
| Hasadás | nincs |
| Törés | horgos |
| Sűrűség | 10-12 g/cm3 |
| Keletkezés | másodlagos, ritkábban hidtotermás |
| Fontosabb lelőhely | Magyarország (Telkibánya, Rudabánya), Szlovákia (Selmecbánya, Hodrusbánya), Románia (Felsőbánya), Norvégia (Kongsberg), Németország (Sankt Andreasberg, Freiburg), Csehország (Jáchymov), Mexikó (Chihuahua), USA (Nagy Medve-tó, Északnyugati területek, Cobalt, Kanada, Michigan, Colorado) |
| Egyéb jellegzetesség | dróttá nyújtható és formára kalapálható |



Forrás: http://www.minerapole.com/
Grafit
| Név | grafit |
| Vegyjel, képlet | C |
| Ásványosztály | terméselemek |
| Kristályrendszer | rombos |
| Kristályalak | ritka kristályok, jellemzően pikkelyes, tömeges halmazok erekben |
| Szín | fekete. szürkésfekete |
| Fény | félig fémes |
| Karc | fekete, barnásszürke |
| Keménység (Mohs-féle) | 1 |
| Hasadás | kitűnően hasad és könnyen transzlatáható |
| Törés | pikkelyes |
| Sűrűség | 2,1-2,3 g/cm3 |
| Keletkezés | metamorf: nagy hőmérsékletű redukciós folyamat trméke v. magmás kőzetelegyrész, esetleg pegmatitos |
| Fontosabb lelőhely | Déli-Kárpátok, Anglia (Borrowdale - Cumbria), Finnország (Pargas), Olaszország (Vezúv), Ausztria (Alpok), Srí Lanka (Galle), Korea, USA (Ticonderoga, Bear Mountain, Ogdensburg) |
| Egyéb jellegzetesség | papíron nyomot hagy, savaknak ellenáll, hajlítható, az elektromosságot vezeti |

Forrás: http://commons.wikimedia.org/wiki/
Gyémánt
|
Név |
gyémánt |
| Vegyjel, képlet | C |
| Ásványosztály | terméselemek |
| Kristályrendszer | szabályos |
| Kristályalak | rendszerint oktaéderes és hexaéderes kristályok, de sokféle habitus lehetséges |
| Szín | általában színtelen, de lehet sárga, barna, szürke, kék, vagy vörös árnyalatú |
| Fény | gyémánt, nyersen zsír |
| Karc | fehér |
| Keménység (Mohs-féle) | 10 |
| Hasadás | tökéletes négy irányban |
| Törés | kagylós |
| Sűrűség | 3,5 g/cm3 |
| Keletkezés | csak kimberlitben (ultrabázisos magmás kőzet) vagy torlatokban fordul elő |
| Fontosabb lelőhely | Oroszország (Mir, Jakutsz), Dél-Afrika (Kimberley), Ausztrália (Ellendale, Argyle, Echunga), Brazília (Minas Gerais, Mato Grosso), USA (Murfreesboro, Arkansas) |
| Egyéb jellegzetesség | Ékkőnek csiszolva „tüze" van, a fényt belülről különféle szögekben veri vissza, a spektrumot színeire bontja; a legkeményebb ásvány! |


Forrás: http://www.minerapole.com/
Terméshigany
| Név | terméshigany |
| Vegyjel, képlet | Hg |
| Ásványosztály | terméselemek |
| Kristályrendszer | trigonális |
| Kristályalak | cseppek vagy tócsák |
| Szín | élénk ezüstszínű |
| Fény | fémes |
| Karc | folyékony, nem hagy karcot |
| Keménység (Mohs-féle) | folyékony, nincs keménysége |
| Hasadás | nincs |
| Törés | nincs |
| Sűrűség | 13,5 g/cm3 |
| Keletkezés | főként cinnabaritból másodlagosan keletkezik |
| Fontosabb lelőhely | Spanyolország (Almadén), Idrija, USA (Santa Clara megye, Sonoma megye, Kalifornia) |
| Egyéb jellegzetesség | folyékony fém |

Forrás: http://commons.wikimedia.org/
Terméskén
| Név | terméskén |
| Vegyjel, képlet | S |
| Ásványosztály | terméslemek |
| Kristályrendszer | rombos |
| Kristályalak | rendszerint tömeges vagy porszerű, de gyakoriak a kristályok is, ritkán előfordulnak tűs kristályok is, ez az ún. rosickyit |
| Szín | élénksárga, sárgásbarna |
| Fény | kristályoknál üvegfény, tömeges megjelenésnél zsírfény vagy földes |
| Karc | fehéres vagy sárga |
| Keménység (Mohs-féle) | 2 |
| Hasadás | tökéletlen |
| Törés | kagylós |
| Sűrűség | 2,0-2,1 g/cm3 |
| Keletkezés | vulkáni kigőzölgésekben és üledékes szulfátok reakciójának eredményeképp |
| Jelentős előfordulás | Magyarország (Margitsziget, Egerszalók, Rudabánya, Gyöngyösoroszi, Nagybörzsöny, Perkupa, Románia (Tusnádfürdő, Kovászna, Gura Haitii), Szlovákia (Kalinka), Olaszország (Szicília), Lengyelország, Franciaország, Oroszország, Japán, Mexikó, USA (Yellostone Nemzeti Park - Wyoming, Sulphurdale - Utah, Louisiana, Texas) |
| Egyéb jellegzetesség | Záptojásszagot áraszthat, nagyon törékeny. Alacsony az olvadáspontja, könnyen meggyullad és kékes lánggal ég, ilyenkor csípős mérges gázok távoznak. |


Forrás: http://www.minerapole.com/
Termésplatina
| Név | termésplatina |
| Vegyjel, képlet | Pt |
| Ásványosztály | terméselemek |
| Kristályrendszer | szabályos |
| Kristályalak | szabálytalan szemcsék vagy törmelékes görgetegek |
| Szín | ezüstfehértől acélszürkéig |
| Fény | fémes |
| Karc | fekete |
| Keménység (Mohs-féle) | 4-6,5 |
| Hasadás | nincs |
| Törés | horgas |
| Sűrűség | 14-22 g/cm3 |
| Keletkezés | likvidmagmás |
| Előfordulás | Norvégia (Finnmark), Oroszország (Kamcsatka), Dél-Afrika (Bushveld-komplexum), Új-Zéland, Peru, Kolumbia, Kína (Szecsuán), USA (Sudburry, Ontario, Goodnews-öböl, Alaszka), Kanada |
| Egyéb jellegzetesség | Mindig szennyezett. Lágy fém, hidegen könnyen alakítható. |

Forrás: http://www.deluxe.hu/cikk/20060404/a_femek_kiralya/
Termésréz
| Név | termésréz |
| Vegyjel, képlet | Cu |
| Ásványosztály | terméselemek |
| Kristályrendszer | szabályos |
| Kristályalak | dendrides (ágas-bogas), pikkelyes |
| Szín | rézvörös, de hamar fakózöldessé válik (patinásodik) |
| Fény | fémes |
| Karc | |
| Keménység (Mohs-féle) | 2,5-3 |
| Hasadás | nincs |
| Törés | horgas |
| Sűrűség | 8,5-8,9 g/cm3 |
| Keletkezés | hidrotermás v. másodlagos |
| Fontosabb lelőhely | Magyarország (Recsk, Rudabánya), Svédország, Olaszország, Németország, Oroszország, Chile, USA (Peninsula, Arizona, New Jersey) |
| Egyéb jellegzetesség | Jól nyújtható, könnyen megmunkálható. Az elektromosságot és a hőt jól vezeti. |


Forrás: http://www.minerapole.com/
II. Szulfidok és rokon vegyületek
"A szulfidok átlagos eloszlása a földkéregben csak 0,2%-ot tesz ki. Ha ebből a két leggyakoribb vasszulfidot (pirit, markazit) levonjuk, arányuk még sokkal kisebbnek adódik, csupán 0,01%-ra tehető. Jelentőségük azonban az emberiség számára alapvető fontosságú, hasznosításuk évezredek óta közismert. A szulfidok fajokban gazdag osztály, jelenleg hozzávetőleg 500 szulfidásványt ismerünk. Elsősorban a Föld nagy mélységű öveire jellemzőek, ahonnan a földkéregbe magmás tevékenység során kerülnek. A földkéregben a bázisos mélységi magmák megszilárdulásakor válnak ki először az előkristályosodás során, de legnagyobb változatosságban a savanyú és intermedier magmákhoz kapcsolódó utókristályosodási folyamatokhoz, főként a hidrotermás tevékenység során keletkeznek."
Szakáll Sándor
Antimonit
| Név | antimonit |
| Vegyjel, képlet | Sb2S3 |
| Ásványosztály | szulfodok és rokon vegyületek |
| Kristályrendszer | rombos |
| Kristályalak | hosszú prizmák, tűs halmazok |
| Szín | ólomszürke |
| Fény | fémes |
| Karc | ólomszürke, eldörzsölve vörös |
| Keménység (Mohs-féle) | 2 |
| Hasadás | az oszlopok mentén jól hasítható; törési felületén keresztirányú sávozottság |
| Törés | egyenetlen, kagylós |
| Sűrűség | 4,6-4,7 g/cm3 |
| Keletkezés | magmás kőzetek járulékos elegyrésze, pegmatitos, hidrotermás, de üledékes és szerves eredetű telepei is gyakoriak |
| Fontosabb lelőhely | Magyarország (Fertőrákos, Gyöngyösoroszi, Mátraszentimre, Parádsasvár, Velencei-hg.), Románia (Kapnikbánya), Szlovákia (Selmecbánya), Olaszország, Franciaország, Japán, Kína, Borneó, Peru, Mexikó, Bolívia, Egyesült Államok |
| Egyéb jellegzetesség | elektromosan nem vezető |

Forrás: http://www.minerapole.com/

Forrás: http://www.smartminerals.com/cina2004/foto_art/Antimonite_Guilin.JPG
Arzenopirit
| Név | arzenopirit |
| Vegyjel, képlet | FeAsS |
| Ásványosztály | szulfidok és rokon vegyületek |
| Kristályrendszer | monoklin |
| Kristályalak | ék, vagy háztetõ formájuak |
| Szín | acélszürkébe hajló ezüstfehér |
| Fény | fémes |
| Karc | szürkésfekete |
| Keménység (Mohs-féle) | 5,5-6 |
| Hasadás | jó |
| Törés | kagylós, egyenetlen |
| Sűrűség | 5,9-6,2 g/cm3 |
| Keletkezése | pemagtitos, pneumatolitos, hidrotermás |
| Fontosabb lelőhely | Magyarország (Velencei-hg, Nagybörzsöny, Gyöngyösoroszi, Kéked, Kővágószőlős, Fertőrákos), Németország, Szerbia, Csehország, Szlovákia, Olaszország, Svédország, Norvégia, USA, Kanada, Ausztrália, Dél-Afrikai Köztársaság |
| Egyéb jellegzetesség | rideg ásvány, fontos arzénérc, kalapálásra fokhagymaszagú |

Forrás: http://hu.wikipedia.org/wiki/Arzenopirit
Cinnabarit
|
Név |
cinnabarit |
|
Vegyjel, képlet |
HgS |
|
Ásványosztály |
szulfidok és rokon vegyületek |
|
Kristályrendszer |
trigonális |
|
Kristályalak |
rombaéderesek, szemcsés kifejlődésűek |
|
Szín |
vörös, néha szürke futtatással |
|
Fény |
gyémánt vagy félig fémesfényű |
|
Karc |
skarlátvörös |
|
Keménység (Mohs-féle) |
2-2,5 |
|
Hasadás |
tökéletes |
|
Törés |
kagylós, egyenetlen |
|
Sűrűség |
8,1 g/cm3 |
|
Keletkezés |
metaszomatikus, hidrotermás |
|
Fontosabb lelőhely |
Magyarország (Velencei-hg., Pátka, Rudabány, Gyönygyösoroszi, Gyönygyössolymos, Sárospatak, Budapest), Szlovákia, Németország, Szlovénia, Olaszország, Németország, Spanyolország, Oroszország, Amerikai Egyesült Államok, Kína, japán |
|
Egyéb jellegzetesség |
rideg, a legfontosabb Hg-érc |


Forrás: http://www.minerapole.com/
Galenit
| Név | galenit |
| Vegyjel, képlet | PbS |
| Ásványosztály | szulfidok |
| Kristályrendszer | szabályos |
| Kristályalak | kocka, tömeges, szemcsés |
| Szín | sötétszürke, néha kékes árnyalattal |
| Fény | fémes, matt |
| Karc | ólomszürke |
| Keménység (Mohs-féle) | 2,5 |
| Hasadás | tökéletes a kocka szerint |
| Törés | egyenetlen |
| Sűrűség | 7,6 g/cm3 |
| Keletkezés | hidrotermás és metaszomikus |
| Jelentős előfordulás | Anglia (Weardale), Csehország (Pibram) Németország (Fekete-erdő, Harz-hegység), Szardínia, Koszovó (Trepca), Oroszország, Ausztrália (Mount Isa), Mexikó (Naica), USA (Missouri - Oklahoma) |
| Egyéb jellegzeteség |

Forrás: http://wannenkopfe.strahlen.org/minerals.html
Kalkopirit
| Név | kalkopirit |
| Vegyjel, képlet | CuFeS2 |
| Ásványosztály | szulfidok és rokon vegyületek |
| Kristályrendszer | tetragonális |
| Kristályalak | áltetraéderek, vesés, tömött, rostozott tömegek |
| Szín | zöldessárga, rézsárga |
| Fény | fémes |
| Karc | zöldesfekete |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | rossz |
| Törés | egyenetlen |
| Sűrűség | 4,2 g/cm3 |
| Keletkezés | hidrotermás, üledékes |
| Fontosabb lelőhely | Magyarország (Recsk, Gyönygyösoroszi, Rudabánya), Szlovákia (Selmecbánya), Románia, Spanyolország, Mexikó |
| Egyéb jellegzetesség | a legfontosabb rézércásvány |

Forrás: http://geology.com/minerals/photos/chalcopyrite-auriferous-278.jpg
Markazit
| Név | markazit |
| Vegyjel, képlet | FeS2 |
| Ásványosztály | szulfidok és rokon vegyületek |
| Kristályrendszer | rombos |
| Kristályalak | táblák, piramisok, gömbös és vesés halmazok, cseppköves |
| Szín | aranysárga szürkés árnyalattal |
| Fény | fémes |
| Karc | zöldesfekete |
| Keménység (Mohs-féle) | 6-6,5 |
| Hasadás | rossz |
| Törés | kagylós, egyenetlen |
| Sűrűség | 4,6-4,9 g/cm3 |
| Keletkezés | magmás, hidrotermás, üledékes és metamorf |
| Fontosabb lelőhely | Magyarország (Recsk, Gyöngyösoroszi, Rudabánya, Perkupa, Keszthely, Telkibánya, Nagybörzsöny, Tatabánya), Románia, Csehország, Oroszország, Ukrajna, Amerikai Egyesült Államok |
| Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Molibdenit
| Név | molibdenit |
| Vegyjel, képlet | MoS2 |
| Ásványosztály | szulfidok és rokon vegyületek |
| Kristályrendszer | hexagonális/trigonális |
| Kristályalak | táblás, lemezes kristályok |
| Szín | ólomszürke |
| Fény | fémfényű |
| Karc | szürkés |
| Keménység (Mohs-féle) | 1-1,5 |
| Hasadás | tökéletes |
| Törés | kagylós |
| Sűrűség | 4,7-5,0 g/cm3 |
| Keletkezés | hidrotermás, pegmatitos |
| Fontosabb lelőhely | Magyarország (Nadap, Sukoró, Pákozd, Nagybörzsöny, Recsk, Kővágószőlős, Fertőrákos), Ausztria, Csehország, Németország, Oroszország, Svédország, Norvégia, Amerikai Egyesült Államok, Japán, Dél-Korea, Ausztrália |
| Egyéb jellegzetesség | Könnyen téveszthető a grafittal, de színe annál világosabb, rendkívül lágy ásvány. |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Pirit
| Név | pirit |
| Vegyjel, képlet | FeS2 |
| Ásványosztály | szulfidok |
| Kristályrendszer | szabályos, de számos forma létezik |
| Kristályalak | Igen változó, hexaéder vagy piritoéder alakú kristályok. Penetrációs vaskereszt ikrek. Szemcsék. Sugaras, tűs kristályok. |
| Szín | sárgaréz színű |
| Fény | fémes |
| Karc | zöldesekete |
| Keménység (Mohs-féle) | 6-6,5 |
| Hasadás | nincs |
| Törés | kagylós |
| Sűrűség | 5,1 g/cm3 |
| Keletkezés | Közönséges ércásvány. Szinte minden magmás, metamorf és üledékes ásványtársulásból ismert. |
| Jelentős előfordulás | Magyarország (Rudabánya, Recsk), Szlovákia (Selmecbánya), Románia (Kapnikánya, Verespatak), Olaszország, Spanyolország, Németország, Oroszország (Berezovszk), Dél-Afrika, Mexikó (Chihuahua), Bolívia, USA (Pennsylvania, Colorado) |
| Egyéb jellegzetesség | fémkalapáccsal ráütve szikrázik |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Realgár
| Név | realgár |
| Vegyjel, képlet | As2S2 |
| Ásványosztály | szulfidok |
| Kristályrendszer | monoklin |
| Kristályalak | zömök, rostozott prizmák; lehet szemcsés, bekérgezés, földes-tömeges |
| Szín | narancssárga, vöröses |
| Fény | gyanta, gyémánt vagy félfémes |
| Karc | narancssárga |
| Keménység (Mohs-féle) | 1,5-2 |
| Hasadás | jó egy irányban |
| Törés | kagylós |
| Sűrűség | 3,5-3,6 g/cm3 |
| Keletkezés | hidrotermás |
| Jelentős előfordulás | Olaszország (Carrara), Svájc (Binntal), Szlovákia (Tajó), Bosznia, Macedónia, Erdély, Románia, Törökország, Kína (Hunan), USA (Mercur - Utah, Getchell, King megye) |
| Egyéb jellegzetesség | fény hatására instabil, arzén! |

Forrás: http://www.desertwindsgemsandminerals.com/realgar/realgar1a_large.JPG

Forrás: http://www.mindat.org/photo-151825.html
Szfalerit
| Név | szfalerit |
| Vegyjel, képlet | α-ZnS |
| Ásványosztály | szulfidok és rokon vegyületek |
| Kristályrendszer | szabályos |
| Kristályalak | tetraéderesek, dodekaéderesek |
| Szín | változó: fekete, barna, zöld, vörös |
| Fény | gyémánt, gyanta |
| Karc | barna, színtelen |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | kítűnően hasad a lapok mentén |
| Törés | kagylós |
| Sűrűség | 3,9-4,2 g/cm3 |
| Keletkezés | pegmatitos, hidrotermás v. üledékes |
| Fontosabb lelőhely | Magyarország (Recsk, Gyönygyösoroszi, Nadap, Telkibánya, Rudabánya, Gánt), Jugoszlávia, Csehország, Szlovákia, Ausztria, Olaszország, Oroszország, Kanada, Amerikai Egyesült Államok, Bolívia |
| Egyéb jellegzetesség | Színe a vastartalom növekedésével sötétebbé válik. A 20%-ot meghaladó vastarttalom esetén az elnevezése: marmatit. |

Forrás: http://members.home.nl/pmestrom/Pictures2-Series1_bestanden/image002.jpg
III. Oxidok és hidroxidok
"Jelenleg közel 450, az oxidok rokonságába tartozó ásványt ismerünk, közöttük egyesek igen gyakoriak. Az oxidok a Föld övei közül a földkéregben találhatók legnagyobb mennyiségben. Átlagos mennyiségük a földkéregben 17%-ra tehető, amiből azonban tekintélyes rész, hozzávetőleg 13% jut az SiO2-ásványokra. Magmás és metamorf kőzetekben, illetve törmelékes üledékekben számos gyakori kőzetalkotó elegyrész oxidásvány. Az SiO2-ásványok után legfontosabb a vas-oxidok szerepe, ezt követően nagyobb jelentősége az Al, Mn, Cr és Ti oxidjainak van. Gazdasági szempontból különösen fontosak a következő elemek oxidjai vagy oxihidroxidjai: vas (hematit, magnetit, goethit), mangán (piroluzit, manganit, romanèchit), króm (kromit), ón (kassziterit), titán (rutil, ilmenit) és urán (uraninit). Végül ne feledkezzünk el a jégről mint ásványról, hiszen
arktikus területeken, illetve magashegységekben általánosan elterjedt."
Szakáll Sándor
Bauxit
| Név | bauxitásványok (gibbsit, diaszpor, bhömit) |
| Vegyjel, képlet | Al(OH)3+AlOOH |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | kőzet, ásványhalmaz |
| Kristályalak | vulkáni iszapban mikroszkopikus zárványok vagy gumók |
| Szín | sokszínű, a sárgás barnától a vörösön át a sötétszürkéig |
| Fény | nincs |
| Karc | sokszínű |
| Keménység (Mohs-féle) | 1-4 |
| Hasadás | nincs jelen |
| Törés | nincs törése, földes |
| Sűrűség | 2-3,74 g/cm3 |
| Keletkezés | üledékes (karszt, laterit) |
| Előfordulás | Magyarország (Gánt, Nyírád, Szőc, Halimba, Eplény, Iszkaszentgyörgy stb.), Oroszország, Kongó, Baku, Azerbajdzsán, Ausztrália, Brazília |
| Egyéb jellegzetesség | Jellegzetes vöröses színét a vas-oxid adja. |

Forrás: http://geologie.vsb.cz/loziska/suroviny/rudy/bauxit%2001_resize.JPG
Hematit
| Név | hematit |
| Vegyjel, képlet | Fe2O3 |
| Ásványosztály | oxidok és hidroxidok |
| Krisályrendszer | trigonális |
| Kristályalak | Jellemzően földes vagy lemezszerű, tömeges, de vese vagy korong formájú kristályok is előfordulnak. |
| Szín | acélszürkétől, feketéig, ha kristály vöröstől barnáig |
| Fény | fémes vagy tompa a földes formákban |
| Karc | vörös |
| Keménység (Mohs-féle) | 5-6 |
| Hasadás | nincs |
| Törés | egyenetlen |
| Sűrűség | 5,3 g/cm3 |
| Keletkezés | Likvidmagmás, pegmatitos, szkarn vagy hidrotermás, metamorf másodlagos, de lehet járulékos kőzetelegyrész is. |
| jelentős előfordulás | Magyarország (Szokolya, Rudabánya, Pécs), Szlovákia (Rozsnyó), Ukrajna (Krivoj Rog), Anglia (Cumbria), Olaszország, Ausztrália, Brazília (Minas Gerais) Kanada |
| Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Gemstones
Korund
| Név | korund |
| Vegyjel, képlet | Al2O3 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | hexagonális |
| Kristályalak | Jellemzően bipiramisok, gyakran hordó vagy orsó alakú. Tömeges, szemcsés halmazokban is előfordul. |
| Szín | a közönséges korund barna vagy barnásfehér |
| Fény |
üveg, gyémánt |
| Karc | fehér |
| Keménység (Mohs-féle) | 9 |
| Hasadás | nincs |
| Törés | kagylós, egyenetlen |
| Sűrűség | 4 |
| Keletkezés | |
| Jelentős előfordulás | Magyarország (Szob, Márianosztra, Verőce, Pákozd, Szentendre, Pomáz), Románia (Ditró, Jádremete), Szlovákia (Ajnácskő), Burma (Mianmar), Thaiföld, Srí Lanka, Afrika, USA (Carolina, Montana) |
| Egyéb jellegzetesség |


Forrás: http://commons.wikimedia.org/wiki/Category:Gemstones
Kuprit
| Név | kuprit |
| Vegyjel, képlet | CuO2 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | szabályos |
| Kristályalak | oktaéderek, dodekaéderek, kockák |
| Szín | különböző árnyalatú vörös, mely a felületén sokszor zöldes vagy szürkés árnyalatú |
| Fény | üveg v. fémes fény |
| Karc | barnásvörös |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | hasadása nem jellemző, csak ritkán érzékelhető |
| Törés | rideg, kagylósan törik |
| Sűrűség | 5,8-6,2 g/cm3 |
| Keletkezés | rézércek oxidációs terméke |
| Fontosabb lelőhely | Magyarország (Nagybörzsöny, Rudabánya), Franciaország, Anglia (Cornwall), Amerikai Egyesült Államokban (Arizonában),Oroszország, Namíbia, Bolívia, Chile, Olaszország (Ligúria és Szardinia) |
| Egyéb jellegzetesség | Ízzitva megolvad réz kiválása mellett. |


Forrás: http://www.minerapole.com/
Kvarc
| Név | kvarc |
| Vegyjel, képlet | SiO2 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | trigonális |
| Kristályalak | rombaéderekkel fedett, hatszöges, prizmás kristályok v. kriptokristályos telérkvarc |
| Szín | színtelen, sokféle árnyalat |
| Fény | üvegfényű, törési felületén zsírfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 7 |
| Hasadás | nincs |
| Törés | kagylós, egyenetlen |
| Sűrűség | 2,65 g/cm3 |
| Keletkezés | magmás, hidrotermás, üledékes |
| Fontosabb lelőhely | Magyarország (Velencei-hg., Gyönygyösoroszi, Gyöngyössolymos), Románia, Brazília |
| Egyéb jellegzetesség | piro- és piezoelektromos |



Forrás: http://www.minerapole.com/
Limonit
| Név | limonit (barnavasérc) |
| Vegyjel, képlet | Fe2O3+nH2O |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | amorf, ásványok keveréke |
| Kristályalak | cseppköves, sugaras, szálas szerkezetű, földes-tömeges |
| Szín | sárgásbarna, rozsdabarna, barna, esetleg vörös |
| Fény | fénytelen, v. szurok |
| Karc | sárgásbarna |
| Keménység (Mohs-féle) | 5-5,5 |
| Hasadás | nincs |
| Törés | egyenetlen |
| Sűrűség | 3,3-4,0 g/cm3 |
| Keletkezés | hidrotermás |
| Fontosabb lelőhely | Magyarország (Rudabánya, Pécs, Mád, Keszthely, Telkibánya), Csehország, Amerikai Egyesült Államokban (Colorado, Utahban, Minesota), Kuba, Brazília, Anglia, Görögország, Románia, Németország, Oroszország, Ukrajna |
| Egyéb jellegzetesség |

Forrás: http://upload.wikimedia.org/wikipedia/commons/6/61/Limonit_(po_pirycie),_Carratraca,_Hiszpania.jpg
Opál
| Név | opál |
| Vegyjel, képlet | SiO2*nH2O |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | amorf, kovasav kocsonya |
| Kristályalak | vaskos, gumós, fürtös, cseppköves, de telérkitöltések is előfordulnak |
| Szín | változó (vörös, fehér, színjátszó, színtelen stb.) |
| Fény | üveg-, gyanta- vagy viaszfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 5,5-6,5 |
| Hasadás | nincs |
| Törés | kagylós |
| Sűrűség | 1,99-2,5 g/cm3 |
| Keletkezés | hidrotermás v. másodlagos |
| Fontosabb lelőhely | Magyarország (Komló, Tállya, Tokaj, Boldogkőváralja), Szlovákia (Veresvágás) |
| Egyéb jellegzetesség |
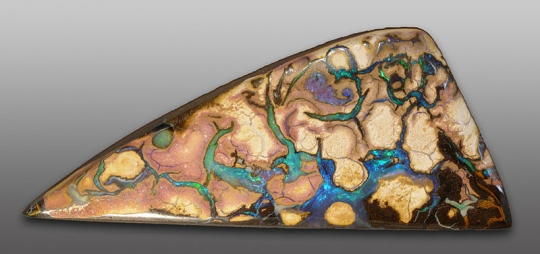


Forrás: http://commons.wikimedia.org/wiki/Category:Gemstones
Piroluzit
| Név | piroluzit |
| Vegyjel, képlet | MnO2 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | rombos |
| Kristályalak | tömeges, szálas megjelenésű, ritka kristályai prizmásak |
| Szín | fekete, sötétszürke |
| Fény | félig fémes |
| Karc | fekete |
| Keménység (Mohs-féle) | 2-7 |
| Hasadás | kitűnő |
| Törés | egyenetlen |
| Sűrűség | 4,7-5 g/cm3 |
| Keletkezés | hidrotermás v. üledékes |
| Fontosabb lelőhely | Magyarország (Eplény, Rudabánya), Németország (Harz-hegység), Csehország, Anglia (Cornwall), Amerikai Egyesült Államok (Georgia, Arkansas), India (Daccan), Brazília, Dél-Afrika, Olaszország (Szardinia) |
| Egyéb jellegzetesség | rideg ásvány, fontos mangánérc |

Forrás: http://hu.wikipedia.org/wiki/Piroluzit
Rutil
| Név | rutil |
| Vegyjel, képlet | TiO2 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | tetragonális |
| Kristályalak | prizmás v. tűs kristályok |
| Szín | sárga, vörös, barna, néha fekete |
| Fény | félig fémes v. gyémánt |
| Karc | barnás |
| Keménység (Mohs-féle) | 6-6,5 |
| Hasadás | jó |
| Törés | kagylós, egyenetlen |
| Sűrűség | 4,2-4,3 g/cm3 |
| Keletkezés | járulékos kőzetalkotó |
| Fontosabb lelőhely | Magyarország (Erdőmecske, Velencei-hg., Legyesbénye, Cserépváralja), Svájc, Szlovákia, Norvégia, Brazília, Amerikai Egyesült Államok, Mexikó, Ausztrália |
| Egyéb jellegzetesség | fontos titánérc ásvány |

Forrás: http://commons.wikimedia.org/wiki/index.html?curid=577890
Spinell
| Név | spinell |
| Vegyjel, képlet | MgAl2O4 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | szabályos |
| Kristályalak | oktaéderek, sokszor görbült lapokkal, gyakran ikerkristélyként |
| Szín | színtelen, vörös, kék, barna |
| Fény | üvegfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 8 |
| Hasadás | nincs |
| Törés | kagylós, egyenetlen |
| Sűrűség | 3,5-3,7 g/cm3 |
| Keletkezés | kontakt metamorf és torlatásvány |
| Fontosabb lelőhely | Magyarország (Salgótarján), Németország (Odenwald), Olaszország (Vezúv), Svédország, Oroszország (Ural-hegység), India, Burma, Srí Lanka, Thaiföld, Ausztrália, Brazília, Amerikai Egyesült Államok |
| Egyéb jellegzetesség | igen ellenálló |

Forrás: http://www.minerapole.com/
Uraninit
| Név | uraninit, uránszurokérc |
| Vegyjel, képlet | UO2 |
| Ásványosztály | oxidok és hidroxidok |
| Kristályrendszer | szabályos |
| Kristályalak | kockatermetű kristályok vagy szálas, ecsetszerű halmazok |
| Szín | acélszürke, sötétbarna, barnásfekete |
| Fény | szurokszerű, félig fémes |
| Karc | |
| Keménység (Mohs-féle) | 5,5 |
| Hasadás | rossz |
| Törés | egyenetlen, kagylós |
| Sűrűség | 7,5-9,7 g/cm3 |
| Keletkezés | pegmatitos vagy hidrotermás, és másodlagosan üledékben is feldúsulhat |
| Jelentős előfordulás | Magyarország (Mecsek), Csehország (Jáchymov), Oroszország, Afrika (Kongó, Nigéria, Kenya, Szomália, Dél-Afrikai Köztársaság) Ausztrália, Kanada (Nagy-Medve tó), USA |
| Egyéb jellegzetesség | radioaktív |

Forrás: http://hu.wikipedia.org/
IV. Szilikátok
"A szilikátok osztályába található a legtöbb ásvány, melyekből jelenleg kb. 1100-at ismerünk (ez az összes ásványok közel 30 %-a). Ennek oka kristályszerkezetük sokfélesége, kémiai változatossága, illetve, hogy legfontosabb alkotóik (Si, O, Al) egyúttal a földkéreg leggyakorib elemei. Becslések szerint a földkéreg mintegy 70-75 %-át szilikátok alkotják (a Si ásványokkal együtt kb. 90-95 %-át!). Néhány kivételtől eltekintve az uralkodó kőzetalkotók mind szilikátok. A talaj, az épitkezéshez használt tégla, építőkő, üveg, szintén nagy százalékban szilikátos fázisokból állnak."
Szakáll Sándor
Berill
| Név | berill |
| Vegyjel, képlet | Be3Al2(SiO6O18) |
| Ásványosztály | szilikátok |
| Kristályrendszer | hexagonális |
| Kristályalak | hatszöges oszlopos v. prizmás kristályai néha tekintélyes méretűek is lehetnek |
| Szín | sokszínű, színétől függően más elnevezésű |
| Fény | üveges |
| Karc | színtelen |
| Keménység (Mohs-féle) | 7,5-8 |
| Hasadés | rossz |
| Törés | egyenetlen, kagylós |
| Sűrűség | 2,65-2,90 g/cm3 |
| Keletkezés | pegmatitos, metamorf |
| Fontosabb lelőhely | Peru, Kolumbia, Amerikai Egyesült Államok, Ausztrália, Oroszország |
| Egyéb jellegzetesség | A nemes berillek közé tartozik a zöld színű smaragd, valamint az égkéktől a tengerkékig terjedő színekben pompázó akvamarin. |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Cirkon
| Név | cirkon |
| Vegyjel, képlet | ZrSiO4 |
| Ásványosztály | szilikátok |
| Kristályrendszer | tetragonális |
| Kristályalak | Piramisos vagy dipiramisos végződésű oszlopok, sugaras vagy szálas halmazok; gyakran ikerkristélyként |
| Szín | sárgásbarna, gyakran színtelen, a sárga színárnyalatok is gyakoriak, szürkészöld, olajzöld, jácintpiros, sötétvörös, ritkán kékes, indigókék |
| Fény | üveg- v. gyémántfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 7,5 |
| Hasadás | rossz |
| Törés | egyenetlen, kagylósan törik, rendkívül rideg, könnyen törik, élei csorbulnak |
| Sűrűség | 4,6-4,7 g/cm3 |
| Keletkezés | magmás kőzetek járulékos elegyrésze, ill. pegmatitosak a nagyobb kristályai |
| Fontosabb lelőhely | Magyarország (Velencei-hg., Tatabánya, Pákozd, Erdőmecske, Szarvaskő, Nézsa, Tihany, Sály, Cserépváralja), Románia, Austria, Olaszország, Németország, Oroszország, Sri Lanka, Madagaszkár, Kambodzsa, Burma, Thaiföld, Mozambik, Ausztrália, Dél-Afrika, Amerikai Egyesült Államokban, Kanada, Brazília |
| Egyéb jellegzetesség | tórium és urán kötődés esetén radioaktivitást mutat, UV fény hatására fluoreszkál |

Forrás: http://commons.wikimedia.org/wiki/File:Cyrkon_Rosja,_Ural.jpg
Kaolinit
| Név | kaolinit |
| Vegyjel, képlet | Al4Si4O10(OH)8 |
| Ásványosztály | szilikátok |
| Kristályrendszer | triklin |
| Kristályalak | földes, tömeges, ritkán kristályos |
| Szín | színtelen, fehér v. halványan színezett |
| Fény | fénytlelen |
| Karc | fehér |
| Keménység (Mohs-féle) | 2-2,5 |
| Hasadás | kitűnő, de nem látható |
| Törés | egyenetlen |
| Sűrűség | 2,5-2,7 g/cm3 |
| Keletkezés | szilikátos kőzetalkotó ásványok málásterméke, de hidrotermás elváltozás végterméke is lehet |
| Fontosabb lelőhely | Magyarország (Mád, Sárisáp, Cserszegtomaj), Románia |
| Egyéb jellegzetesség | fontos kerámia nyersanyag |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Krizotilazbeszt
| Név | krizotilazbeszt (szerpentin) |
| Vegyjl, képlet | Mg6Si4O10(OH)8 |
| Ásványosztály | szilikátok |
| Kristályrendszer | monoklin |
| Kristályalak | hosszú, lapos, oszlopos vagy prizmás kristályok, lehet vékonyszálas (rostos), tömeges |
| Szín | zöldessárga, fehér |
|
Fény |
üveg, selyem |
| Karc | fehér |
| Keménység (Mohs-féle) | 2,5-3 |
| Hasadás | kiválóan hasad a szálak mentén |
| Törés | egyenetlen |
| Sűrűség | 2,5-2,6 g/cm3 |
| Keletkezés | kőzetalkotó, főleg dolomit; metamorf kőzetek elegyrésze |
| Jelentős előfordulás | Magyarország (Csódi-hegy), Oroszország, Kanada, USA, Mexikó |
| Egyéb jellegzetesség | tűz- és lúgálló, hő-, hang- és elektromos szigetelő |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Jadeit
| Név | jadeit |
| Vegyjel, képlet | Na(Al2Fe)Si2O6 |
| Ásványosztály | szilikátok |
| Kristályrendszer | monoklin |
| Kristályalak | ritkák, nyúltak, prizmásak |
| Szín | zöld, de lehet barna és fehér is |
| Fény | üvegfényű |
| Karc | színtelen |
| Keménység (Mohs-féle) | 6-7 |
| Hasadás | jó |
| Törés | szilánkos |
| Sűrűség | 3,24 g/cm3 |
| Keletkezés | metamorf |
| Fontosabb lelőhely | Kína (Tien-San) |
| Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Gránát
| Név | gránát |
| Vegyjel, képlet | A3B2(SiO4) |
| Ásványosztály | szilikátok |
| Kristályrendszer | szabályos |
| Kristályalak | rombdodekaéderesek, deltoid-24-esek |
| Szín | sötétvörös, barnás vörös, sárgás esetenként zöld |
| Fény | üveg v. zsírfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 6,5-7,5 |
| Hasadás | nincs |
| Törés | |
| Sűrűség | 3,5-4,3 g/cm3 |
| Keletkezés | járulékos kőzetalkotó, a legszebb kristályai szkarn és metamorf kőzetekben található |
| Fontosabb lelőhely | Magyarország (Börzsöny patakmedreiben, Sály, Tihany, Visegrád), Csehország, Szlovákia, Németország, Oroszország, Finnország, Norvégia, Törökország, Madagaszkár, Amerikai Egyesült Államok |
| Egyéb jellegzetesség |

Olivin
| Név | olivin |
| Vegyjel, képlet | (Mg,Fe)2SiO4 |
| Ásványosztály | szilikátok |
| Kristályrendszer | rombos |
| Kristályalak | zömök, oszlopos kristályai ritkák |
| Szín | olaj- v. palackzöld, esetleg sárga |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 6,5-7 |
| Hasadás | közepes |
| Törés | kagylós |
| Sűrűség | 3,2-3,4 g/cm3 |
| Keletkezés | kőzetalkotó (bázisos és ultrabázisos magmás kőzetekben) |
| Fontosabb lelőhely | Magyarország (Sitke, Gérce, Szentbékkálla, Kapolcs, Badacsony, salgótarján), Olaszország (Vezúv) |
| Egyéb jellegzetesség | a nagyobb Mn-tartalmúak tűzállóak, az átlátszó példányok drágakő minőségűek |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Muszkovit
| Név | muszkovit |
| Vegyjel, képlet | KAl2Si3O10(OH)2 |
| Ásványosztály | szilikátok |
| Kristályrendszer | monoklin |
| Kristályalak | álhatszöges táblás, lemezes, esetleg pikkelyes kristályok |
| Szín | színtelen vagy alig színeződötten halványzöld vagy halványsárga |
| Fény | üveg v. gyönygház |
| Karc | színtelen |
| Keménység (Mohs-féle) | 2,5 |
| Hasadás | tökéletes |
| Törés | egyenetlen |
| Sűrűség | 2,7-3,1 g/cm3 |
| Keletkezés | kőzetalkotó v. pegmatios |
| Fontosabb lelőhely | Magyarország (Sopron, Velencei-hg., Sukoró, Pákozd, Szarvaskő), Kanada, Oroszország, India, Brazília, Szlovákia, Románia, Amerikai Egyesült Államok |
| Egyéb jellegzetesség | nagyon vékony, rugalmas lemezekké hasítható, melyek elektromos szigetelők |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Talk
| Név | talk |
| Vegyjel, képlet | Mg3Si4O10(OH)2 |
| Ásványosztály | szilikátok |
| Kristályrendszer | szabályos |
| Kristályalak | leginkább tömött lemezes halmazok csillámszerű megjelenéssel |
| Szín | sápadt-, sötétzöld, szürke v. barna |
| Fény | zsír-, üveg- v. gyöngyház |
| Karc | fehér |
| Keménység (Mohs-féle) | 1 |
| Hasadás |
tökéletes |
| Törés | egyenetlen |
| Sűrűség | 2,58-2,83 g/cm3 |
| Keletkezés | metamorf v. hidrotermás |
| Fontosabb lelőhely | Magyarország (Felsőcsatár), Ausztria |
| Egyéb jellegzetesség | tapintás zyíros, tűz- és saválló |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Topáz
| Név | topáz |
| Vegyjel, képlet | Al2((OH,F)2SiO4) |
| Ásványosztály | szilikátok |
| Kristályrendszer | rombos |
| Kristályalak | Zömök, oszlopos, táblás, szemcsés |
| Szín | víztiszta, de leggyakrabban sárga, ritkán kék, ibolya vagy piros színű |
| Fény | üveg v. gyönygház |
| Karc | fehér |
| Keménység (Mohs-féle) | 8 |
| Hasadás | kitűnő |
| Törés | félkagylós, egyenetlen |
| Sűrűség | 3,5 g/cm3 |
| Keletkezés | pegmatitos, torlatos |
| Fontosabb lelőhely | Oroszország (Bajkál-tó, Urál), Srí Lanka, Brazília, Mexikó, Amerikai Egyesült Államok |
| Egyéb jellegzetesség |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Turmalin
| Név | turmalin |
| Vegyjel, képlet | XY3Z6(BO3T6O18(OH,F,O)4 |
| Ásványosztály | szilikátok |
| Kristályrendszer | trigonális |
| Kristályalak | oszlopos kristályok v. sugaras halmazok, csak ritkán tömeges |
| Szín | nagyon változatos átlátszóan fehértől a feketéig az ékszeriparban 45 színváltozata ismert, többszínű és színváltó példányai is előfordulnak |
| Fény | üveg |
| Karc | színtelen |
| Keménység (Mohs-féle) | 7-7,5 |
| Hasadás | nincs |
| Törés | egyenetlen, kagylós |
| Sűrűség | 2,9-3,3 g/cm3 |
| Keletkezés | pegmatitos v. hidrotermás |
| Fontosabb lelőhely | Magyarország (Velencei-hg.,Pákozd, Nagybörzsöny, Eplény, Sály, Sopron, Recsk, Sukoró), Szlovénia, Horvátország, Németország(Harz-hegység), Ausztria (Tirol), Olaszország, Norvégia, Anglia (Cornwall), Oroszország, Tanzánia, Namíbia, Srí Lanka, Madagaszkár és Mozambik, Amerikai Egyesült Államok (New York, Új-Hampshire, Maine, California), Brazília, Afganisztán, Ausztrália |
| Egyéb jellegzetesség | piezo- és piroelektromos |



Forrás: http://www.minerapole.com/
V. Foszfátok és rokon vegyületek
"A foszfátok és rokon ásványaik alapvetően a földkéreg felszín közeli zónáiban és a felszínen találhatók meg. Különösen nagy változatosságban ismertek ércesedések oxidációs zónájában. Ezektől kivételt képeznek a pegmatitok foszfátjai, illetve a magmás és metamorf kőzetekben járulékos kőzetalkotóként szinte mindig jelenlévő apatit-csoport tagjai. Gazdasági jelentősége azonban - dacára a jelenleg ismert közel 660 foszfát-, (arzenát-, és vanadát-) ásványnak - jószerével csak az apatit-csoport ásványainak van, hiszen az osztályba tartozó ásványok hozzávetőleg 80-90%-a kifejezetten ritka ásványnak tartható."
Szakáll Sándor
Apatit
| Név | apatit |
| Vegyjel, képlet | Ca5(PO4)3(F, OH, Cl) |
| Ásványosztály | foszfátok |
| Kristályrendszer | hexagonális |
| Kristályalak | nyúlt vagy zömök hatszöges oszlopok, esetleg szemcsés, tömött halmazok |
| Szín | színtelen, fehér, sárga, zöld, kék, vörös vagy barna |
| Fény | üveg a törésfelületeken zsír |
| Karc | fehér |
|
Keménység (Mohs-féle) |
5 |
| Hasadás | nincs, kagylós törésű |
| Törés | kagylós, egyenetlen |
| Sűrűség | 3,1-3,2 g/cm3 |
| Keletkezés | magmás kőzetek járulékos elegyrésze, pegmatitos, hidrotermás, de üledékes és szerves eredetű telepei is gyakoriak |
| Jelentős előfordulás | Magyarország (Salgótarján, Nagybörzsöny, Pécsely), Oroszország (Kola-fésziget.), Norvégia, Németország |
| Egyéb jellegzetesség | UV-fényben illetve katód és röntgen sugárzás hatására fluoreszkál |

Forrás: http://www.seilnacht.com/Chemie/apatit.JPG

Forrás: http://commons.wikimedia.org/wiki/
Lazulit
| Név | lazulit |
| Vegyjel, képlet | (Mg,Fe)Al2(OHPO4)2 |
| Ásványosztály | foszfátok és rokon vegyületek |
| Kristályrendszer | monoklin |
| Kristályalak | dipiramisszerű v. táblás, egyszerű formakombinációkból állú kristályok |
| Szín | égkék, kékesfehér |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 5-6 |
| Hasadás | rossz |
| Törés | egyenetlen |
| Sűrűség | 3,1 g/cm3 |
| Keletkezés | ritka kőzetalkotó, pegmatitos |
| Fontosabb lelőhely |
Magyarország (Sopron, Ágfalva), Ausztria, Svájc |
| Egyéb jellegzetesség |

Forrás: http://www.minerapole.com/

Forrás: http://commons.wikimedia.org/wiki/Category:Gemstones
Vivianit
| Név | vivianit |
| Vegyjel, képlet | Fe3(PO4)2·8H2O |
| Ásványosztály | foszfátok és rokon vegyületek |
| Kristályrendszer | monoklin |
| Kristályalak | oszlopos termetű v. apró táblás kristályok, esetleg földes, szemcsés halmazok |
| Szín | színtelen, de oxidálódva megkékül, sötétzöld, feketébe hajló sötétkék |
| Fény | üveg- vagy gyöngyházfényű |
| Karc | színtelen, de kékre, ill. barnára változik |
| Keménység (Mohs-féle) | 1,5-2 |
| Hasadás | kitűnő |
| Törés | egyenetlen |
| Sűrűség | 2,6-2,7 g/cm3 |
| Keletkezés | másodlagos |
| Fontosabb lelőhely | Magyarország ( |
| Egyéb jellegzetesség | szép kristályai drágakő minőségűek |


Forrás: http://www.minerapole.com/
VI. Szulfátok és rokon vegyületeik
"A szulfátok és rokon vegyületeik alapvetően a földkéreg felszínhez közeli részein, illetve a föld felszínén képződnek. A szulfátásványok tekintélyes számban - több mint 400 faj - ismertek a természetben, azonban közülük nagy gyakorisággal csak néhány jelenik meg (például gipsz, barit, jarosit)."
Szakáll Sándor
Anhidrit
| Név | anhidrit |
| Vegyjel, képlet | CaSO4 |
| Ásványosztály | szulfátok és rokon vegyületek |
| Kristályrendszer | romboéderes |
| Kristályalak | főleg vaskos, szemcsés, tümeges. esetleg szálas, rostos halmazok v. gömbös, vesés, cseppköves |
| Szín | átlátszó, de gyakran kissé kékes, ibolyás vagy sárgás |
| Fény | üvegfényű |
| Karc | |
| Keménység (Mohs-féle) | 3-3,5 |
| Hasadás | három kristálytani sík mentén kiváló |
| Törés | |
| Sűrűség | 2,95 g/cm3 |
| Keletkezés | tengervízből kősó kíséretében v. hidrotermás érctelérekben, esetleg vulkáni exhalációkban |
| Fontosabb lelőhely | Magyarország (Rudabánya), Ausztria |
| Egyéb jellegzetesség | pora vízzel keveredve lassan gipszé alakul |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Barit
| Név | barit |
| Vegyjel, képlet | BaSO4 |
| Ásványosztály | szulfátok és rokon vegyületek |
| Kristályrendszer | rombos |
| Kristályalak | többnyire táblás kristályok, néha megnyúlt alakban, gyakori cseppkőszerű. gumós halmazokban v. tömegesen is |
| Szín | sárga v. fehér, néha barnás, kékes v. vöröses |
| Fény | üveg |
| Karc | fehér, színtelen |
| Keménység (Mohs-féle) | 2,5-3,5 |
| Hasadás | jó |
| Törés | kagylós |
| Sűrűség | 4,48 g/cm3 |
| Keletkezés | hidrotermás, üledékes |
| Fontosabb lelőhely | Magyarország (Rudabánya, Dorog, Nyírjes, Bajót, Budapest, Gánt, Sárospatak, Nagybörzsöny, Recsk, Sukoró, Pátka, Nadap), Anglia, Csehország, Románia, Olaszország, Tunézia, Amerikai Egyesült Államok |
| Egyéb jellegzetesség | fontos nyersanyag a papír-, festék- és mélyfúróiparban |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Cölesztin
| Név | cölesztin |
| Vegyjel, képlet | SrSO4 |
| Ásványosztály | szulfátok és rokon vegyületek |
| Kristályrendszer | rombos |
| Kristályalak | táblás v. megnyúlt kristályok, de gyakoriak a rostos, szemcsés és lemezes tömött halmazai is |
| Szín | színtelen, fehér, gyakra kék, ritkábban vörös v. zöld |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 3-3,5 |
| Hasadás | jó |
| Törés | egyenetlen |
| Sűrűség | 3,9-4,0 g/cm3 |
| Keletkezés | hidrotermás |
| Fontosabb lelőhely | Magyarország (Gyöngyösoroszi, Eplény, Zsámbék), Rómánis (Rézbánya), Szlovákia (Úrvölgy), Belgium, Németország, Spanyolország, Olaszország, Anglia, Hollandia, Lengyelorzág, Törökország, Algéria, Marokkó, Tunézia, Oroszország, Mexikó, Amerikai Egyesült Államok |
| Egyéb jellegzetesség | fontos ipari nyersanyag magas stronciumtartalma miatt |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Gipsz
|
Név |
gipsz |
|
Vegyjel, képlet |
CaSO4·2H2O |
|
Ásványosztály |
szulfátok |
|
Kristályrendszer |
monoklin |
|
Kristályalak |
3 fő formája. Ezek: a szelenit kristályai, a rostos szaténpát, illetve a finomszemcsés, tömeges alabástrom. Finom „százszorszépeket" és sivatagi rózsát is képez sokféle felületen, sivatagi környezetben. Táblás, lapos vagy prizmás kristályok. |
|
Szín |
rendszerint fehér, színtelen vagy szürke, de lehet vörös, barna vagy sárgás árnyalatú is |
|
Fény |
üveg, gyöngyház |
|
Karc |
fehér |
|
Keménység (Mohs-féle) |
2 |
|
Hasadás |
egy irányban kiváló, két másikban még észlelhető |
|
Törés |
szilánkos |
|
Sűrűség |
2,3 g/cm3 |
|
Keletkezés |
üledékes |
|
Előfordulás |
Magyarország (Gyöngyösoroszi, Recsk, Rudabánya, Perkupa, Nagyvisnyó, Budapest, Alsótelekes, Imola, Gánt, Tokod, Dorog, Komló, Tatabánya), Szlovákia (Selmecbánya), Románia (Kapnikbánya, Torda), Anglia (Nottinghamshire), Németország (Türingia, Bajorország), Olaszország (Volterra, Bologna, Pavia), Franciaország (Montmarte, Párizs), Afrika (Szahara), Ausztrália (Whyalia, Tasmánia, Pernatty-lagúna), Mexikó (Naica), USA (Alfaalfa megye - Oklahoma, Mammoth-barlangok, Kentucky) |
|
Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Kalkantit
| Név | kalkantit (rézvirág) |
| Vegyjel, képlet | CuSO4.5H2O |
| Ásványosztály | szulfátok és rokon vegyületek |
| Kristályrendszer | triklin |
| Kristályalak | elsősorban cseppköves bekérgezések, kristályosan ritka |
| Szín | kék, égkék, néha kissé zöldes árnyalattal |
| Fény | üveg |
| Karc | színtelen |
| Keménység (Mohs-féle) | 2,5 |
| Hasadás | tökéletlen |
| Törés | kagylós |
| Sűrűség | 2,1-2,5 g/cm3 |
| Keletkezés | rézércek oxidációs övében másodlagos |
| Fontosabb lelőhely | Bisbee, Arizona, USA, Chuquicamata, Chile, Rio Tinto Spanyolország, a Rammelsberg bányák Herzsabányán Nagybánya mellett, Selmecbánya, Hodrushámor, Körmöcbánya, Nandrás, Szomolnok, Úrvölgy |
| Egyéb jellegzetesség | kereskedelmi neve: rézgálic |

Forrás: http://hu.wikipedia.org/wiki/Kalkantit
Volframit
| Név | volframit |
| Vegyjel, képlet | (Fe,Mn)WO4 |
| Ásványosztály | szulfátok és rokon vegyületek |
| Kristályrendszer | monoklin |
| Kristályalak | kissé nyúlt, táblás kristályai a végek felé vésőszerűen kivékonyodnak, telérekben tömeges |
| Szín | sötétbarna, barnás fekete, néha vöröses árnyalatú |
| Fény | zsír, félig fémes |
| Karc | fekete |
| Keménység (Mohs-féle) | 5-5,5 |
| Hasadás | jó |
| Törés | egyenetlen |
| Sűrűség | 7,2-7,6 g/cm3 |
| Keletkezés | pegmatitos v. hidrotermás |
| Fontosabb lelőhely | Magyarország (Velencei-hg.), Románia (Felsőbánya), Németország (Érc-hegység), Spanyolország, Portugália, Olaszország (Szardínia), Anglia, Csehország, Oroszország, Kína, Burma, Malajzia, Ausztrália, Kanada, Amerikai Egyesült Államok (Colorado és Új-Mexikó), Peru és Bolívia |
| Egyéb jellegzetesség | legfontosabb volfrámérc |

Forrás: http://www.minerapole.com/

Forrás: http://www.hummingbirdminerals.com/IMG_6438n.jpg
VII. Borátok, karbonátok, nitrátok
"A természetben jelenleg kb. 110 borátásványt ismerünk. Ezek túlnyomó része igen ritkán fordul elő, csak néhány jelenik meg nagyobb mennyiségben sótelepeken, boraxtavak kiválásai között. Egy kis részük pedig magmás, illetve metamorf környezetben képződik. A karbonátok a földkéreg felszínközeli részén, illetve a felszínen igen elterjedt ásványok. Jelenleg A nitrátok erősen ionos jellegű, sótermészetű vegyületek. Vízben könnyen oldódnak, kis keménységűek. Emiatt alapvetően száraz klímán stabilisak (főként sivatagi éghajlat alatt), ahol jellegzetes bepárlódási termékekként jelennek meg. A természetben mintegy 15 nitrátásványt ismerünk, közülük azonban csak a nátronsalétromnak és a kálisalétromnak van gyakorlati jelentősége." Szakáll Sándor
mintegy 200 karbonátásványt ismerünk a természetben. Számunkra gyakoriságuk és gazdasági jelentőségük miatt különösen a vízmentes karbonátok három csoportja fontos: a kalcit-, aragonit- és dolomit-csoport. Ezekből az ásványokból nagyon elterjedt karbonátos üledékes kőzetek (például mészkő, dolomit, márga), illetve metamorf kőzetek (például márvány, dolomárvány) épülnek föl.
Aragonit
| Név | aragonit (vasvirág) |
| Vegyjel, képlet | CaCO3 |
| Ásványosztály | borátok és karbonátok |
| Kristályrendszer | rombos |
| Kristályalak | álhatszöges ikerkristályok, cseppkőszerű ágas-bogas |
| Szín | színtelen, fehér, sárgás vagy barnás, ritkán ibolyás |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | rosszul |
| Törés | kagylós |
| Sűrűség | 2,94 g/cm3 |
| Keletkezés | hidrotermás, üledékes |
| Fontosabb lelőhely | Magyarország (Badacsony, Dorog, Kesztölc, Tokod, Süttő, Lábatlan, Tatabánya, Gellért-hegy), Németország (Kaiserstuhl), Csehország, Spanyolország, Ausztria(Karintiában), Olaszország (Sziciliában és Vezúv), Franciaország, Amerikai Egyesült Államok (Arizona és Új-Mexikó) |
| Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals

Forrás: http://www.minerapole.com/
Azurit
| Név | azurit |
| Vegyjel, képlet | Cu3(CO3)2(OH)2 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | monoklin |
| Kristályalak | rostos, sugaras, fürtös, vesés halmazok, kéregszerű bevonatok v. zömök oszlopos, esetleg táblás apró v. szépen fejlett kristályok |
| Szín | sötét azurkék színűek, tömött szemcsés halmazai világosabbak |
| Fény | üveg |
| Karc | világoskék |
| Keménység (Mohs-féle) | 6,5 |
| Hasadás | jól hasad a kristálylaok mentén |
| Törés | kagylós, egyenetlen |
| Sűrűség | 3,8 g/cm3 |
| Keletkezés | másodlagos, rézéerctelepek oxidációs övében |
| Fontosabb lelőhely | Magyarország (Rudabánya, Recsk), Franciaország (Lyon), Görögország, Románia, Ausztrália (Új Dél-Wales), Chile, Kína, Oroszország, Irán, Amerikai Egyesült Államok (Arizona), Mexikó, Olaszország(Szardinia) |
| Egyéb jellegzetesség |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Cerusszit
| Név | cerusszit |
| Vegyjel, képlet | PbCO3 |
| Ásványosztály | borátpk, karbonátok, nitrátok |
| Kristályrendszer | rombos |
| Kristályalak | apró, nyúlt kristályok, gyakranikerként v. rostos, vaskos, földes megjelenésű |
| Szín | fehér, barna, sárga, néha fekete árnyalattal |
| Fény | gyémántfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 3-3,5 |
| Hasadás | rossz |
| Törés | kagylós, egyenetlen |
| Sűrűség | 6,4-6,6 g/cm3 |
| Keletkezés | szulfidos ólomércek oxidációs övében |
| Fontosabb lelőhely | Magyarország (Pákozd, Nadap, Rudabánya, Gyöngyösoroszi, Nagyvisnyó), Románia területén az erdélyi Rézbányán (Baita). Németország (Siegerland, Baden-Württemberg, Fekete-erdő, Freiburg), Csehország (Pribram), Ausztria (Karintia), Anglia (Durham), Görögország (trákia és Kykladia), Olaszország (Szardínia-szigete, Vicenza és Veneto), Oroszország (Altaj-hegység), Namíbia és Zaire, Ausztrália, Amerikai Egyesült Államok (Illinois, Utah, Colorado és Kentucy) |
| Egyéb jellegzetesség | fontos ólomérc |

Forrás: http://www.minerapole.com/
Dolomit
| Név | dolomit |
| Vegyjel, képlet | CaCO3*MgCO3 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | trigonális |
| Kristályalak | romboéderek |
| Szín | fehér v. világosszürke |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | kitűnő |
| Törés | kagylós |
| Sűrűség | 2,8-2,95 g/cm3 |
| Keletkezés | hidrotermásan érckisérő, üledékesen kőzetalkotó |
| Fontosabb lelőhely | Magyarország (Vértes, Bakony, Budai-hg., Gánt, Iszkaszentgyörgy), Olaszország (Dolomitok) |
| Egyéb jellegzetesség |


Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Kalcit
|
Név |
kalcit |
|
Vegyjel, képlet |
CaCO3 |
|
Ásványosztály |
borátok, karbonátok, nitrátok |
|
Kristályrendszer |
trigonális |
|
Kristályalak |
kristályformákban gazdag, főként romboéderes és szkalenoéderes kristályai közismertek |
|
Szín |
színtelen, fehér, esetleg halványan színezett |
|
Fény |
üveg |
|
Karc |
fehér |
|
Keménység (Mohs-féle) |
3 |
|
Hasadás |
kitűnő |
|
Törés |
kagyós |
|
Sűrűség |
2,71 g/cm3 |
|
Keletkezés |
hidrotermás, üledékes kőzetalkotó |
|
Fontosabb lelőhely |
Magyarország (Csódi-hegy, Budai-hg., Recsk, Rudabánya), Anglia (Engremont) |
|
Egyéb jellegzetesség |


Forrás: http://www.minerapole.com/

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Magnezit
| Név | magnezit |
| Vegyjel, képlet | MgCO3 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | trigonális |
| Kristályalak | főleg romboéderes, ritkán prizmás termetű kristályok v. tömeges megjelenésű |
| Szín | sárgás v. szürkésfehér, esetleg barna |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 3,5-4,5 |
| Hasadás | kitűnő |
| Törés | kagylós, egyenetlen |
| Sűrűség | 2,9-3,1 g/cm3 |
| Keletkezés | hidrotermás, metaszomatikus, metamorf |
| Fontosabb lelőhely | Magyarország (Nagybörzsöny, Budai-hg.), Ausztria, Németország, Szlovákia (Jolsva (Jelsava), Lubenyik, Baráttelke (Magnezitovce) és Rozsnyó)Lengyelország, Olaszország, Norvégia és Svédország, Görögország, Törökország, Oroszország (Ural-hegység), Amerikai Egyesült Államok (Arizona, Nevada és Kalifornia)Kína (Mandzsuria), Brazília |
| Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Malachit
| Név | malachit |
| Vegyjel, képlet | Cu2CO3(OH)2 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | monoklin |
| Kristályalak | rendszerint rostos, szálas v. vesés, fürtös megjelenésű |
| Szín | smaragzöld, halványzöld |
| Fény | üveg (selyem) |
| Karc | zöld |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | jó |
| Törés | félkagylós |
| Sűrűség | 3,9-4,1 g/cm3 |
| Keletkezés | másodlagos |
| Fontosabb lelőhely | Magyarország (Erdőmecske, Recsk, Rudabánya), Oroszország (Ural-hegység), Zaire, Namíbia, Chile, Ausztrália, Amerikai Egyesült Államokban (Arizona és Utah), Németország, Franciaország, Románia, Olaszország (Elba és Szardínia) |
| Egyéb jellegzetesség |
Forrás: http://www.minerapole.com/
Rodokrozit
| Név | rodokrozit |
| Vegyjel, képlet | Mn2+CO3 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | trigonális |
| Kristályalak | főleg romboéderes termetű kristályok |
| Szín | rózsaszínű, málnaszínű, néha szürke vagy barna |
| Fény | üvegfényű, gyönygyházfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 3,5-4 |
| Hasadás | kitűnő |
| Törés | egyenetlen, kagylós törésű |
| Sűrűség | 3,3-3,7 g/cm3 |
| Keletkezés | hidrotermás, másodlagos |
| Fontosabb lelőhely | Magyarország (Nagybörzsöny, Úrkút, Gyöngyösoroszi, Eplény), Románia (Kapnikbánya, Máramaros, Herzsabánya és Nagybánya), Németország, Spanyolország, Franciaország (Pireneusok), Olaszország, Oroszország (Ural-hegység), Amerikai Egyesült Államok (Colorado és Montana) Mexikó, Argentína, Dél-afrikai Köztársaság, Peru, Japán (Hokiado) |
| Egyéb jellegzetesség |


Forrás: http://www.minerapole.com/
Smithsonit
| Név | smithsonit |
| Vegyjel, képlet | ZnCO3 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | trigonális, hexagonális |
| Kristályalak | csak romboéderes kristályokban v. gömbös, vesés, cseppköves bekérgezésben ismert |
| Szín | fehér, sárga,szürkésfehér, zöldes, kék, barna, színe a szennyezettség függvényében változik |
| Fény | üvegfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 4,5-5 |
| Hasadás | kitűnő |
| Törés | egyenetlen |
| Sűrűség | 4,4-4,5 g/cm3 |
| Keletkezés | másodlagos |
| Fontosabb lelőhely | Magyarország (Nagyvisnyó, Szabadbattyánban, Parádsasváron, Recsken és Rudabánya), Románia (Szászkabány és Dognácska), Szlovákia (Rozsnyó és Selmecbánya), Ausztria (Karintia, Bleiberg és Steinmark), Lengyelország, Németország (Harz-hegység, Badenben és Nesler), Franciaország (Rajna vidéken és Lyon), Olaszország (Szardínia), Oroszország (Ural-hegység és Szibéria), Amerikai Egyesült Államok (Arizonai Silver Hill, Arkansas, Utah, Új-Mexikó), Mexikóban, Ausztrália (Új-Dél-Wales), Vietnam |
| Egyéb jellegzetesség |

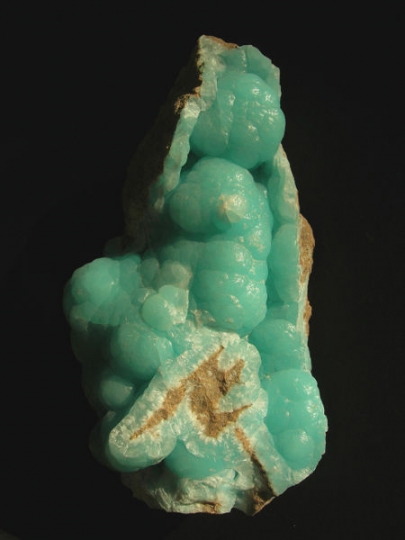
Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
Sziderit
| Név | sziderit (vaspát) |
| Vegyjel, képlet | FeCO3 |
| Ásványosztály | borátok, karbonátok, nitrátok |
| Kristályrendszer | trigonális |
| Kristályalak | egyszerű romboéderes kristályok v. vaskosan pátos, tömeges, sugaras változata: szferosziderit |
| Szín | sárgásfehér, világosbarna, szürke |
| Fény | üvegfényű |
| Karc | fehér |
| Keménység (Mohs-féle) | 3,5-4,5 |
| Hasadás | tökéletes a kristálylapok mentén |
| Törés | egyenetlen |
| Sűrűség | 3,7-3,9 g/cm3 |
| Keletkezés | pegmatitos, hidrotermás |
| Fontosabb lelőhely | Magyarország (Recsk, Rudabánya), Ausztria, Anglia (Cornwall), Oroszország, Ukrajna, Amerikai Egyesült Államokban (Connecticuban és Pennsyilvánia), Kanada, Grönland, Brazília , Svájc, Németország, Franciaország, Románia, Algéria Tunézia, Ausztrália |
| Egyéb jellegzetesség |

Forrás: http://commons.wikimedia.org/wiki/Category:Minerals
VIII. Halogenidek
"A természetben ma közel 220 halogenidet ismerünk. Jelentős részük üledékes körülmények között képződik a földkéreg felszínközeli zónáiban, illetve a felszínen. A fluoridok keletkezése azonban eltér a többi halogenidtől, hiszen zömmel pneumatolitos és hidrotermás eredetűek. Ezzel szemben a kloridok, bromidok és jodidok nem kis része vulkáni exhaláció során képződik. Közvetve ebből származik a tengervíz klórtartalma, illetve ebből képződve, a sótelepekben (evaporitokban) nagy mennyiségben ismertek halogenidek."
Szakáll Sándor
Fluorit
| Név | fluorit, folypát |
| Vegyjel, képlet | CaF2 |
| Ásványosztály | halogének |
| Kristályrendszer | szabályos |
| Kristályalak | jellemzően hexaéderes vagy oktaéderes kristályok, illetve mindkettő |
| Szín | Igen változatos, élénk bíborszínű, kék, zöld vagy sárga, vöröses narancssárga, rózsaszínű, fehér vagy barna. Egyetlen kristályon belül is lehetnek különböző színű övek. A tiszta, szennyezetlen kristályok színtelenek. |
| Fény | üveg |
| Karc | fény |
| Keménység (Mohs-féle) | 4 |
| Hasadás | tökéletes négy irányban, oktaédert formálva |
| Törés | lapos, kagyló alakú |
| Sűrűség | 3-3,3 g/cm3 |
| Keletkezés | hidrotermás |
| Jelentősebb előfordulás | Magyarország (Sukoró, Pákozd, Mórágy, Gyöngyösoroszi, Recsk, Alsótelekes), Szlovákia (Selmecbánya), Románia (Kapnikbánya, Erzsébetbánya), Anglia (Alston, Moor, Weardale, Castleton, Cornwall), Németország (Harz-hegység, Wölsendorf), Olaszország (Toszkána), Svájc (Göschenen), Oroszország (Urál-hegység, Dalnyegorszk), India (Maharástra), Kína, Mexikó (Naica, Chihuahua), USA (Tenessee, Illinois, Ohio, Új-Mexikó) |
| Egyéb jellegzetesség |
A fluorit áttetsző vagy átlátszó. Jellemzően fluoreszkáló ibolyakék vagy ritkábban zöld, fehér, vörös vagy lila. Termolumineszcencia, foszforeszkálás és dörzslumineszcencia egyaránt jellemző rá. |


Forrás: http://www.minerapole.com/
Halit
| Név | kősó, halit |
| Vegyjel, képlet | NaCl |
| Ásványosztály | halogenidek |
| Kritályrendszer | szabályos |
| Kristályalak | főként kocka alakú kristályok üledékrétegekben de lehet szemcsés vagy szálas is |
| Szín | átlátszó vagy fehér, de lehet narancssárga, rózsaszínű, lila, sárga vagy kék |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 2 |
| Hasadás | tökéletes három irányban, kocka szerint |
| Törés | kagylós |
| Sűrűség | 2,1 g/cm3 |
| Keletkezés | üledékes |
| Jelentős előfordulás | Magyarország (Perkupa, Paks, Duna-Tisza köze), Lengyelország (Wieliczka), Szlovákia (Sóvár), Ukrajna (Sóvár), Románia (Rónaszék, Désakna, Parajd, Szováta, Marosújvár, Torda), Németország (Stassfurt), Ausztria (Salzburg), Franciaország (Mulhouse), USA (Nagy-sóstó, Utah), tengerek (Holt-tenger, Vörös-tenger) |
| Egyéb jellegzetesség | plasztikus és vágható, fény hatására a kristályok sötétednek |


Forrás: http://de.wikipedia.org/wiki/Halit
Kriolit
| Név | kriolit, jégkő |
| Vegyjel, képlet | Na3(AlF6) |
| Ásványosztály | halogenidek |
| Kristályrendszer | monoklin |
| Kristályalak | hexaéder termetű kristályok vagy vaskos, tömeges |
| Szín | vöröses, zöldes, színtelen, sárga, barna |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 8-8,5 |
| Hasadás | nincs |
| Törés | egyenetlen |
| Sűrűség | 2,97 g/cm3 |
| Keletkezése | pegmatitos, pneumatolitos |
| Előfordulása | Dánia (Grönland), Oroszország, USA |
| Egyéb jellegzetesség | olvadáspont csökkentő |

Forrás: http://www.gemandmineral.com/owensphotos.html
Szilvin
| Név | szilvin |
| Vegyjel, képlet | KCl |
| Ásványosztály | halogenidek |
| Kristályrendszer | szabályos |
| Kristályalak | kockák, oktaéderek tompíthatják |
| Szín | gyengén színezett, főleg sárgára |
| Fény | üveg |
| Karc | fehér |
| Keménység (Mohs-féle) | 2 |
| Hasadás | kitűnő |
| Törés | egyenetlen |
| Sűrűség | 1,9-2 g/cm3 |
| Keletkezés | üledékes |
| Előfordulás | Németország (Stassfurt), Lengyelország (Wieliczka), Oroszország |
| Egyéb jellegzetesség | kesernyés ízű |

Forrás: http://ruby.chemie.uni-freiburg.de/Vorlesung/Fotos/Alkalimetalle/sylvin.jpg
IX. Szerves ásványok
"A szerves ásványokként megjelenő, földtani folyamatok során képződött vegyületek, túlnyomó többségében a bioszféra állati vagy növényi anyagainak közremüködésével jönnek létre a föld felszínén vagy a földkéreg legfelső zónáiban. Ezeket három nagy csoportba soroljuk: szerves savak sói, szénhidrogének és kevert szerves vegyületek."
Szakáll Sándor
Borostyánkő
| Név | borostyánkő |
| Vegyjel, képlet | ≈C78H11O10S |
| Ásványosztály | szerves ásványok |
| Kristályrendszer | amorf |
| Kristályalak | nem kristályos, alakja szabálytalan |
| Szín | mézsárga, vörösbarna, áttetsző |
| Fény | gyanta |
| Karc | |
| Keménység (Mohs-féle) | 2-2,5 |
| Hasadás | nincs |
| Törés | kagylós |
| Sűrűség | 1,06-1,10 |
| Keletkezés | megkeményedett fosszilis fenyőgyanta |
| Fontosabb lelőhely | Magyarország (Ajka), Németország (Varnemünde), Oroszország, Libanon, Burma |
| Egyéb jellegzetesség | A borostyánkő kis fajsúlya miatt fennmarad a víz színén, éghető anyag, s ezzel az egyetlen éghető díszkő, dörzsölésre statikus áramot vesz fel. Híres arról a tulajdonságáról, hogy kitűnő állapotban őrzi meg a még képlékeny állapotában beleragadt kisebb állatokat, elsősorban ízeltlábúakat. |


Forrás: http://www.minerapole.com/
Mellit
| Név | mellit |
| Vegyjel, képlet | C6(COO)6Al2·18H2O |
| Ásványosztály | szerves ásványok |
| Kristályrendszer | tetragonális |
| Kristályalak | oktaéderhez hasonló kettős piramisok |
| Szín | méz- és viaszsárga |
| Fény | gyanta (üveg) |
| Karc | színtelen, fehér |
| Keménység (Mohs-féle) | 2-2,5 |
| Hasadás | nincs |
| Törés | kagylós |
| Sűrűség | 1,6 g/cm3 |
| Keletkezés | másodlagosan barnakőszéntelepeken |
| Fontosabb lelőhely | Magyarország (Csordakút), Csehország |
| Egyéb jellegzetesség | Hevítve meggyullad, az égéstermék fehér por. Lágy, késsel vágható. |


Forrás: http://www.asahi-net.or.jp/~ug7s-ktu/e_mellit.htm
Fogalomtár
Kristálytan: Témakörébe tartozik a kristályok alaktani, belső szerkezeti, fizikai és kémiai tulajdonságainak vizsgálata.
Ásványtan (minerológia): Ásványokkal kapcsolatos tudomány. Témakörébe a Föld szilárd kérgét (litoszféra) alkotó kőzetek ásványi összetételének vizsgálata tartozik.
Kőzettan: Témakörébe a kőzetek tulajdonságainak és keletkezésük körülményeinek leírása tartozik.
Kristály: Homogén, diszkontinuális térkitöltésű, anizotróp térrács, aminek külső megnyilvánulása a síklapokkal határolt mértani test.
Ásvány: A szilárd földkéregben természetes úton keletkezett, meteoritokban található, élőlényekhez nem kötött, egyöntetű (homogén), legtöbbször egységes kémiai összetételű, rendszerint kristályos anyagok.
Kőzet: A szilárd földkérget felépítő, megközelítően változatlan ásványi és kémiai összetételű ásványhalmazok elnevezése.
Érc: (latin: aes, aeris) Kőzet vagy ásvány, amelyből valamilyen elem (pl.: Fe, Pb, Au, Al és hasonlók) hasznosan nyerhető ki. (Bronzszerű ötvözet, amelyet az ókorban gyakran használtak fegyverekhez és hadifelszerelésekhez.)