Kémiai kötések
Koordinációs számnak nevezzük azt a számot, amely megmutatja, hogy egy kérdéses tömegpontot hány közvetlenül szomszédos tömegpont vesz körül egyenlő távolságban (38. ábra).
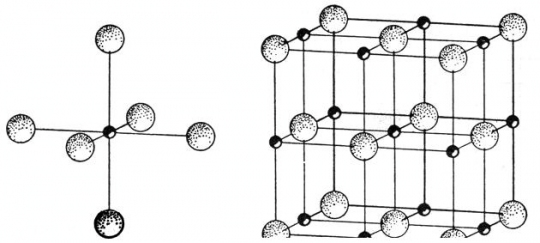 38. ábra. NaCl kristályrács a 6-os koordinációs szám kiemelésével
38. ábra. NaCl kristályrács a 6-os koordinációs szám kiemelésével
Ionrácsok
Az ionvegyületeket elektrosztatikus erők tartják össze. A kristályrács kialakításában három fő tényező érvényesül.
1. Egy központi iont, minél nagyobb számú ellentétes töltésű ion vegyen körül.
2. Az ellentétes töltésű ionok arra törekszenek, hogy egymástól minél nagyobb távolságra rendeződjenek el.
3. A kationra és anionra vonatkoztatott koordinációs számnak a sztöchimertrikus viszonyokkal kell összhangban lennie.
Az ionrácsok fizikai tulajdonságai:
- általában színtelenek.
- vízben és poláris oldószerekben jól oldódnak.
- nem vezetők, de olvadékuk és oldatuk az elektromos áramot jól vezeti.
- fénytörésük közepes.
- a keménység, olvadáspont, forráspont az ionok közötti távolsággal fordítottan arányos.
A. Izodezmikus szerkezetek (amelyekben az ionok között mindenhol azonos erõsségű kötőerők hatnak).
AB típus:
Cézium-klorid (CsCl)
Felépítése: 2 szabályos egyszerű cella, amelyek egy fél testátlóval vannak egymásba tolva. A Cs+ kationok az így létrejött cella csúcsain, a Cl- anionok a cella közepén helyezkednek el.
Koordinációs szám: [8]
Kötésmód: hexaéderes (39. ábra)
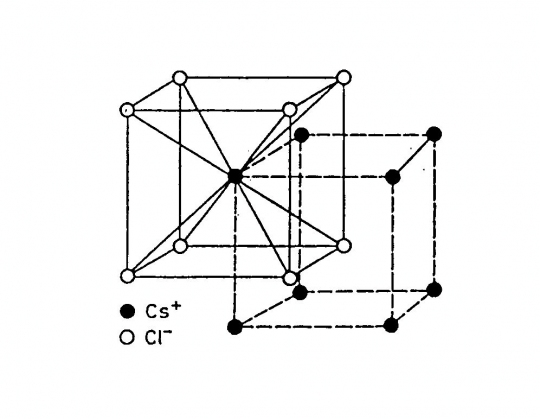 39. ábra. Cézium-klorid rács
39. ábra. Cézium-klorid rács
(Ilyen típusú rácsban kristályosodik a cézium-bromid (CsBr) és a cézium jodid (CsI) is.)
Nátrium-klorid, kősó (NaCl)
Felépítése: 2 szabályos lapcentrált cella, amelyek fél cellaéllel vannak egymásba tolva. Ennek következtében a Na+ kationok a cella csúcsain és lapközepein, a Cl- anionok az élek felezőpontjában és a cella közepén helyezkednek el.
Koordinációs szám: [6]
Kötésmód: oktaéderes (40. ábra)
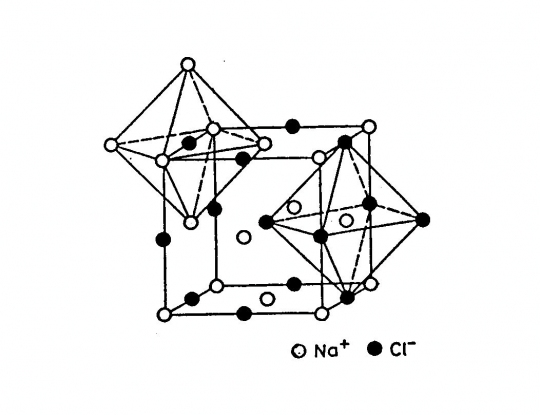 40.ábra. NaCl rács
40.ábra. NaCl rács
(Kősó típusú rácsa van a szilvinnek (KCl), a galenitnek (PbS), az alabandinnak (MnS), és a periklásznak (MgO) is.)
AB2 típus:
Fluorit (CaF2)
Felépítése: 3 szabályos lapcentrált cella, amelyek a cellaél felével, ill. a testátló negyedével vannak egymásba tolva. A Ca2+ kationok a cella csúcsain és lapközepein, a F- anionok az 1/8 részkockák közepén helyezkednek el.
Koordinációs szám: Ca2+ F- ® [8], F- Ca2+ ® [4]
Kötésmód: hexaéderes ill. tetraéderes (41. ábra).
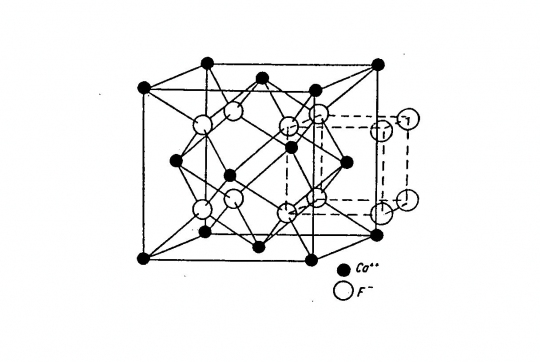 41. ábra. CaF2-rács.
41. ábra. CaF2-rács.
(Fluorit szerkezeti típusa van az uránszurokércnek (UO2) is, antifluorit rácsa például az argentitnek (Ag2S).)
B. Mezodezmikus szerkezetek (a szilikátok szerkezete).
A szilikátok a földkéreg legelterjedtebb ásványai, ré¥gebben a feltételezett hipo-, orto-, metakovasavak sóinak tekintették. A szilikátok alapeleme az (SiO4)4- -gyök, ahol a Si4+ -t tetraéderesen négy O2- környékezi. A (SiO4)4- -gyökök 1-1 oxigén révén kapcsolódhatnak egymáshoz, vagy a szabad vegyértékeikkel kationokat kötnek le. Ily módon az (SiO4)4- -gyökök csoportokban, végtelen láncokban, síkrácsokban, vagy térhálókban illeszkednek az alábbi módon:
1. Sziget, vagy nezoszilikátokban önálló (SiO4)4- tetraéderek vannak, amelyeket általában két és három vegyértékű kationok kompenzálnak. Pl.: olivin (Fe, Mg) SiO4 , gránát-félék stb.
2. Csoport vagy szoroszilikátokban 2, 3, 4, 6 (SiO4)4- tetraéder 1-1 O2- révén kapcsolódik egymáshoz, (SiO2O7)6- , (SiO3O9)6- , (SiO4O12)8- , (SiO6O18)12- alapképlettel. A nezo- és szoroszilikátok nagy keménységű és fénytörésű ásványok, a "drágakövek" nagy része ilyen szerkezetű.
3. Lánc- és szalag, v. inoszilikátok az (SiO4)4- tetraéderek 2 O2-, ill. 4 O2- révén (Si2O6)4- láncot, ill. ¥ (Si2O11)6- szalagot alkotnak. Képviselői a piroxének és az amfibólok.
4. Fillo-vagy réteg szilikátok: a (SiO4)4- tetraéderek 3-3 oxigénje közös. Az alapképletük (Si4O10)4-. Ide soroljuk a csillámokat (pl. biotit, muszkovit).
5. Ásvány- térhálós vagy szilikátok az (SiO4)4--gyök három irányban mind a 4 O2--el kapcsolódik a szomszédos tetraéderhez, Ilyen a kvarc és módosulatai, valamint a magmás kőzetek leggyakoribb ásványa, az ortoklász és plagioklász (* földpátok) (42. ábra).
 42. ábra. SiO2 tetraéderek kapcsolódásának módja
42. ábra. SiO2 tetraéderek kapcsolódásának módja
C. Anizodezmikus szerkezetek, amelyekben az ionok önálló csoportként önálló építőegységként jelennek meg.
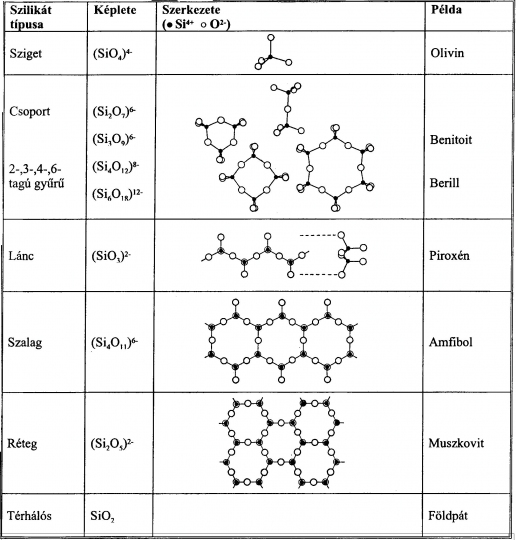
Kalcit (CaCO3)
Ha a kősó elemi celláját az egyik trigiroid irányban állítjuk fel úgy, hogy a cellaélek által bezárt szög 102° /tehát nem 90°/ legyen, és minden Na+ kation Ca2+ kationnal és minden Cl- aniont karbonátionnal (CO32-) helyettesítünk, megkapjuk a hasadási romboéder elemi celláját.
A CO32- anionok planáris elrendeződésűek, a cellaélek közepén és a cella térközepén síkjukkal a (0001) indexű rácssíkokkal párhuzamosan helyezkednek el. A cella csúcsait és lapközepeit a Ca2+ kationok foglalják el.
Koordinációs szám a kősó rácshoz hasonlóan. [6] (43. ábra)
 43. ábra. Kalcit-rács
43. ábra. Kalcit-rács
(A kalcittal egyező típusú szerkezete van a rodokrozitnak (MnCO3), a smithsonitnak (ZnCO3), a szideritnek (FeCO3), a magnezitnek (MgCO3) és a chilei salétromnak (NaNO3) is.)
Aragonit (a rombos CaCO3).
Atomrácsok
Az atomokat kovalens kötés tarja össze.
Jellemzői:
1. A kötésszög iránya 180°-nál kisebb is lehet.
2. Csak a periódusos rendszer IV. oszlopában van meg a lehetőség arra, hogy az elemek atomjai háromdimenziós rácsot hozhassanak létre.
3. A koordinációs számot, a meglévő vegyértékviszonyok korlátozzák.
4. Intenzitásban a kovalens kötés lényegében nem különbözik az ionos kötéstől.
5. Elektromos vezetőképesség szempontjából az atom- és ionrácsok alapvetően különböznek egymástól. Az atomrácsos kristályok olvadék állapotban sem vezetik az elektromos áramot.
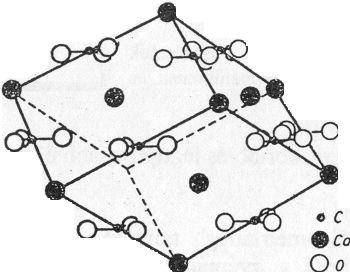
Gyémánt (C)
Felépítése: cellája két szabályos minden lapon centrált elemi cellából vezethető le, amelyek a testátló negyedével vannak egymásba tolva. Az egymásbatolás eredményeként a szénatomok a szabályos lapcentrált cella csúcsain, lapközepén és a váltakozó térnyolcadok közepén helyezkednek el.
Koordinációs szám: [4]
Kötésmód: tetraéderes (44. ábra)
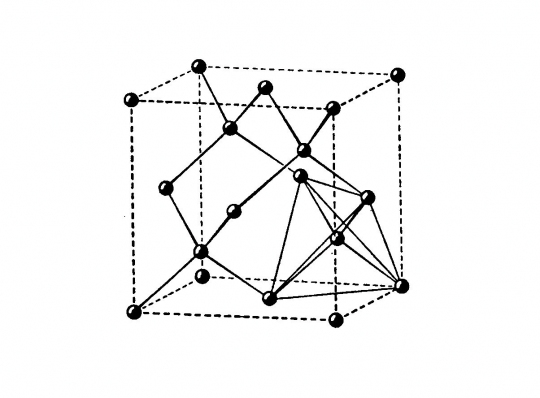 44. ábra. Gyémántrács
44. ábra. Gyémántrács
(Ilyen típusú szerkezete van az elemek közül a szilíciumnak, germániumnak és az ónnak is.)
A gyémánt leggyakoribb és legtípusosabb növekedési alakja, kristályformája, az oktaéderlap.
Szfalerit (ZnS)
Felépítése: Geometriailag teljesen azonos felépítésű a gyémántráccsal. A különbség az, hogy az egyik lapcentrált cellában a szénatomok helyét a cinkatomok, a másik lapon centrált cellában kénatomok foglalják el (45. ábra).
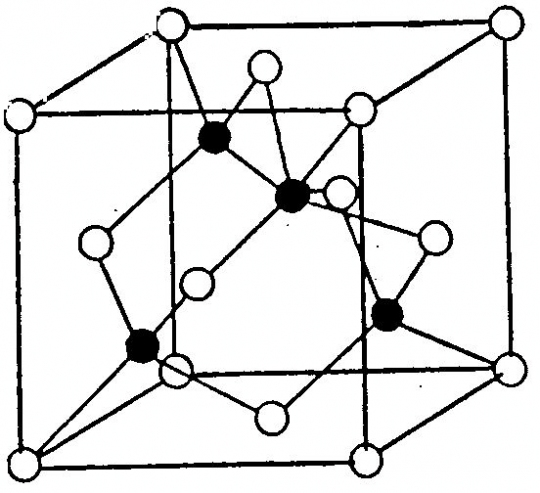 45. ábra. Szfalerit-rács
45. ábra. Szfalerit-rács
(A szfaleriten kívül ilyen típusú rácsa van az ércásványok közül a metacinnabaritnak (HgS),a tiemannitnak (HgSe), a koloradoitnak (HgTe). Közel áll a szfalerit-rácshoz a wurtzit-rács, különbség, hogy a két szomszédos koordinációs tetraéder a szfaleritnél inverzióspont szerint, a wurtzitnál tükörsík szerint kapcsolódik össze.)
Fémrács típusok
A fémes kötés a jellemző.
Sajátságai:
1. A vegyértékelektronok nem lokalizálódnak a szomszédos atomok közé, hanem a kristályrács egészéhez tartoznak.
2. A fémes kötésnél nincs kitüntetett irány. A kötés gömbszimmetrikus. A koordinációs számmal kapcsolatban a fémes rácsoknál nincs sem térbeli, sem számbeli korlátozás. Maximális koordinációs számok alakulhatnak ki.
3. Az elektronfelhő elmozdulási lehetőségével kitűnően értelmezhető a termikus és az elektromos vezetőképesség, az optikai sajátság, nagy reflekcióképesség.
1/ Szoros értelemben vett fémrácsok (homodezmikus szerkezetek)
a/ Szabályos szoros illeszkedésű rács (réz-típus):
Minden egyes fématomot saját síkjában, egyenlő távolságban 6 /vele egyező nagyságú/ atom vesz körül. Az említett atom felett és alatt, szintén egyenlő távolságban, 3-3 atom egymáshoz képest 60°-kal van elforgatva.
Minden harmadik sík azonos helyzetű, s a szoros illeszkedés síkjára merőlegesen inverziós trigiroidot találunk. A szoros illeszkedés síkjának a (111) indexű rácssíkok, azaz az oktaéderlapok felelnek meg. A szabályos lapcentrált cellában kristályosodó fémek az oktaéderlapok mentén, tehát 4 irányban siklathatók és ezért kitűnően nyújthatók, megmunkálhatók.
A kationok által kitöltött tér a kristályrács egész térfogatához képest 74%.
Koordinációs szám: [12] (46. ábra)
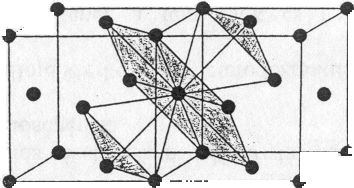 46. ábra. Szabályos szoros illeszkedésű rács (pl. Cu, Ag, Au, Pt, *-Fe)
46. ábra. Szabályos szoros illeszkedésű rács (pl. Cu, Ag, Au, Pt, *-Fe)
b/ Szabályos tércentrált rács (wolfram-típus):
Az atomok által kitöltött tér a kristályrács egészéhez képest 68%. A szabályos tércentrál cellával rendelkező fémek fizikai sajátságai nem olyan kedvezőek, mint a szabályos, szoros illeszkedést mutató fémek esetében. Nincs kitüntetett siklatási irányuk. Kevésbé megmunkálhatók, nyújthatók, merevebbek. Példa erre a tércentrált cellás alfa-Fe és lapcentrált cellás gamma-Fe eltérő viselkedése. Előbbi rosszul, utóbbi kitűnően nyújtható. 906°C-on az alfa-Fe ugrásszerűen gamma-Fe-sá alakul. A vasat azért kell megmunkálás, hengerlés előtt a vörös izzás hőmérsékletére emelni, hogy ez az átalakulás végbemenjen.
Koordinációs szám: [8] (47. ábra).
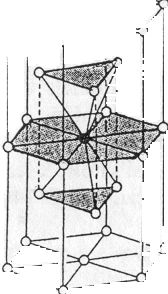 47. ábra. Az alfa-vas gamma-vassá történő átalakulásának szerkezeti magyarázata
47. ábra. Az alfa-vas gamma-vassá történő átalakulásának szerkezeti magyarázata
(A W, Li, Na, K, Mo-re is ilyen cella jellemző.)
c/ Hexagonális szoros illeszkedésű rács (magnézium-típus):
Minden tömegpontot saját síkjában 6 vele egyező nagyságú tömegpont vesz körül egyenlő távolságban. A központi atom felett és alatt egyenlő távolságban 3-3 tömegpont helyezkedik el. A felső és alsó tömegpontok egymáshoz képest nincsenek 60°-kal elforgatva. Ennek következtében minden második sík helyzete azonos és a szoros illeszkedés síkjára merőleges egy hexagír. A szoros illeszkedés síkja (0001) kristálylapnak felel meg.
Ennek következtében a hexagonális rendszerű fémek a bázislap szerint siklathatók és ezért nyújthatók, megmunkálhatók, bár nyújthatóságuk a szabályos lapcentrált cellájú fémekét nem éri el.
Koordinációs szám: [12] (48. ábra)
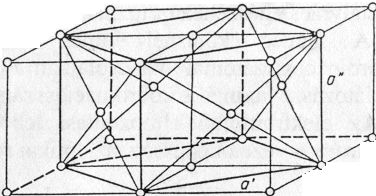 48. ábra. Hexagonális szoros illeszkedésű rács (Mg, Zn, Cd, Ti)
48. ábra. Hexagonális szoros illeszkedésű rács (Mg, Zn, Cd, Ti)
Az azonos rácstípusban való kristályosodás alapja a fémek egymással való elegyedésének, ötvözhetőségének.
2/ Metalloid szerkezetek (heterodezmikus szerkezetek)
Grafit
Átmenetet képez a fémrácsok és a molekularácsok között. Jellegzetes kétdimenziós, rétegrácsos szerkezete van. A bázislapokkal párhuzamosan nem csak a hőt és az elektromosságot vezeti kitűnően, hanem ugyanezzel a síkkal párhuzamosan kitűnő transzlációs sajátságot mutat. Ezen alapul ceruzaként való használata. A C-atomok hatos gyűrűket képeznek, a hatos gyűrűk síkja a (0001) lapnak megfelelő rácssíkkal párhuzamos. A szomszédos szénatomok távolsága a rácssíkban 0,142 nm.
A szomszédos rácssíkok egymástól való távolsága 0,335 nm. A hatos gyűrűk minden páros síkban egymás alatt helyezkednek el (49. ábra).
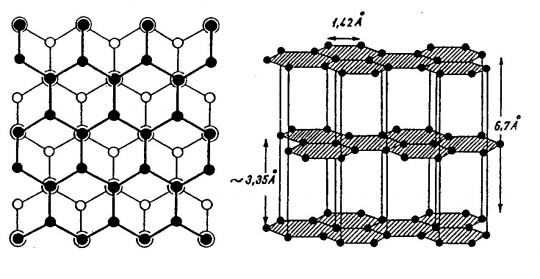 49. ábra. Grafitrács
49. ábra. Grafitrács
Molekularácsok
Olyan heterodezmikus szerkezetek, amelyekben a tömegpontok helyét molekulák foglalják el.
A molekulák közötti kötést a gyenge van der Waals-féle erők, indukciós vagy diszperziós erők biztosítják. Az intermolekuláris erők mindig sokkal gyengébbek, mint a molekulán belüli (intramolekuláris) erők. Így a molekularácsoknál az összetartó erő és a rácsenergia csekély.
Keménységük kicsi, olvadás- és forráspontjuk alacsony, összenyomhatóságuk nagy. Párolgás- és olvadáshőjük alacsony. Háromdimenziós, kétdimenziós és egydimenziós szerkezeteket különböztetünk meg.
Széndioxid (CO2):
Felépítése: szabályos lapcentrált cella, amelyben a tömegpontok helyét CO2 molekulák foglalják el.
Koordinációs szám: [12] (50. ábra)
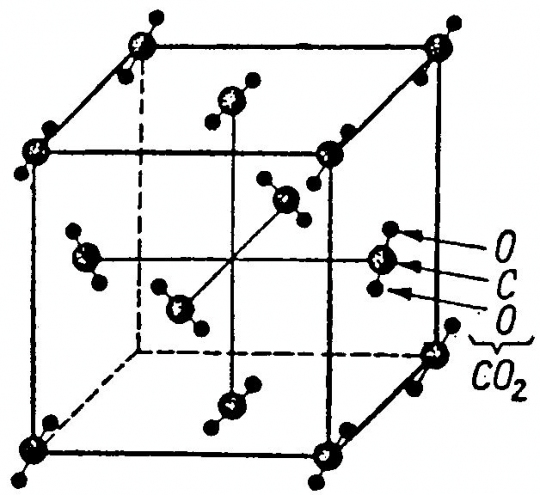 50. ábra. A szén-dioxid molekularácsa
50. ábra. A szén-dioxid molekularácsa
(Ilyen a rácsa még a kénnek, SiF4-nak és szinte minden szerves vegyületnek.)